该来的总要来,CFDA8月11日关于生产工艺自查的新闻再次刷爆朋友圈。PS:新手请备好尿壶,老人们早已长年穿着尿不湿。CFDA一忙,药企就要跟着更忙了。
我们对比了一下,征求意见稿与此前无码流出版的差别。这一版有了更加科学的修正,主要有以下变化:
1
标题即变幻风格
标题由《关于进一步加强药品生产工艺监管的公告》变为《关于开展药品生产工艺核对工作的公告》。
原文为“监管”,变更为“核对”,行文的主体发生变化,由面向监管方的管理口吻变为面向药品生产企业的公告。
新版标题也放弃了使用“自查”、“核查”这种严厉威慑恐怖的字眼,变得用词温柔考究。不恰当的比愉,政府监管者的形象由严肃的行业法官,转变为温婉尔雅的举牌女郎。有人说,这明显是婆婆变妈妈,注意,不要挑拨民事矛盾。
这种调整,看似无足轻重,但背后体现的是政府职能由管理向服务转变的思路。这种转变,不仅体现于一规一文,对行业的影响会比较深远,意义重大。
2
背景缓缓导入
开篇新增了政策导入描述,背景音乐响起,主持人婉转介绍背景,循序渐进,避免被不懂装懂的吃瓜媒体报道而引起民众恐慌。这一点是相当英明的。
新增“药品生产工艺是持续稳定地生产出合格药品的过程和方法,按照监管部门批准的生产工艺组织生产是保障药品质量的前提。为加强药品生产工艺管理,原国家食品药品监督管理局于2007年8月部署开展了注射剂类药品生产工艺和处方核查工作,各省局对企业申报登记的生产工艺等相关资料进行了审查,初步建立了注射剂生产工艺等资料档案。2007年10月修订实施的《药品注册管理办法》规定批准药品上市前应进行生产现场检查,保障了技术审评部门核定的生产工艺的可行性,此后批准上市的绝大多数药品的实际生产工艺与批准的生产工艺是一致的。近年来,食品药品监管部门在监督检查中发现仍有部分2007年前批准上市的品种未按照批准的生产工艺组织生产、改变生产工艺不按规定研究和申报。为此,总局决定开展药品生产工艺核对工作。”
这段小词说得真考究漂亮,清晰地给我们描述了一幅由远渐进的画面,体现了监管工作的持续连贯、不断加强。
对用药安全影响较大的注射剂,2007通过8月就已经开展核查了嘛。然后,进一步框定范围,2007年10月修订的注册办法之后,我们是一直保持严格审评、现场检查状态,这些品种也是管理得不错滴,老百姓们不必害怕。
随后话锋一转,近年来,我们还是发现了部分老品种存在私自改动工艺情况,2007年前上市的部分老品种哦。
看完这一段,吃瓜群众惊呆张大的嘴已经可以慢慢闭上,继续咀嚼吃瓜。
3
有收有放,时限提前
原方案为2016年12月31日之前完成自查,一刀切。而现在调整为“药品生产企业应于2016年10月1日前完成自查并将自查情况报所在地省级食品药品监管部门。省级食品药品监管部门应对企业自查情况进行汇总,填写自查情况汇总表并于2016年11月1日前上报食品药品监管总局”。
对发生工艺变更的,也区分了在产品种与暂不生产品种,拉开时限差,避免不生产品种也扎堆凑热闹,比较科学。“2017年6月30日前完成在产品种生产工艺的研究验证、提交备案或补充申请等相关工作,其他暂不生产品种应于2017年12月31日前完成上述工作”。
4
柔性停产,不再惊人的一刀切
原方案“实际生产工艺与核准批准生产工艺不一致的,应立即停止生产或进口”,这一条最惊悚。如果按这个来执行,不能排除不少大品种出现熔断式断片。
新方案中,按工艺变更是否对产品质量产生影响而区分,“经研究验证,生产工艺变化对药品质量产生影响的,企业应立即停产”,生产工艺变化对质量不产生影响的,可以继续生产。
新方案尤其增加了两条例外,相信很多人看完之后,长舒一口气,这泡尿可以舒心地尿出来了。久病不起的患者也是这样闭眼的。
第一条例外是,我是2007年前就违规改动工艺的,改了之后一直就这样干,干了至少10年,产品质量可控,安全有效,今天可以不停产。呼啦啦,过来一群群众,都举着胳膊呼喊,我们都是这么干的!!
第二条例外是,变更的工艺属于技术进步或创新的,可以不停产。哗啦啦,同样一波群众又过来了,我们都是这么干的!!
……
PS:
1、躲过10年监管,一直违规生产,终有合法一天。被逼上任的质量授权人,可以睡安稳觉了。
2、10年工艺不变更,不管是不是合法,时间也挺长了。
3、但凡变更,都是为了质量可控、安全有效,基本也都是技术进步。有人傻到把工艺变不稳定,安全变危险吗?
5
弱化了外企
民间版中提到了药品生产企业,含境外制药厂商,本版中特意删掉了。在正文的多处描述中,如程序,都是盯住了内资企业的。虽说外企也可以按照《药品注册管理办法》中的要求进行补充申请,但明显没有文字提及。
在时限管理上,“药品生产企业应于2016年10月1日前完成自查并将自查情况报所在地省级食品药品监管部门。省级食品药品监管部门应对企业自查情况进行汇总,填写自查情况汇总表并于2016年11月1日前上报食品药品监管总局”,明显不是针对外企。
6
生产工艺自查逻辑图
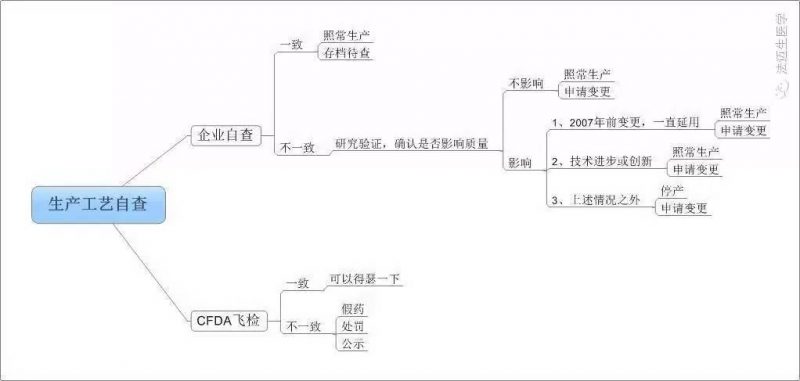
不多说,来看看流出版与征求意见版的全文比对吧,注:红色为原版文字描述,蓝字为新增文字。
关于进一步加强开展药品生产工艺监管核对工作的公告
(征求意见稿)
根据药品监督检查信息,部分药品生产企业存在不按照食品药品监管部门核准的生产工艺生产药品的问题。为进一步规范药品生产秩序,解决药品生产企业不按照核准生产工艺生产药品、变更生产工艺不按规定研究和申报的问题,现就有关事项公告如下:
药品生产工艺是持续稳定地生产出合格药品的过程和方法,按照监管部门批准的生产工艺组织生产是保障药品质量的前提。为加强药品生产工艺管理,原国家食品药品监督管理局于2007年8月部署开展了注射剂类药品生产工艺和处方核查工作,各省局对企业申报登记的生产工艺等相关资料进行了审查,初步建立了注射剂生产工艺等资料档案。2007年10月修订实施的《药品注册管理办法》规定批准药品上市前应进行生产现场检查,保障了技术审评部门核定的生产工艺的可行性,此后批准上市的绝大多数药品的实际生产工艺与批准的生产工艺是一致的。近年来,食品药品监管部门在监督检查中发现仍有部分2007年前批准上市的品种未按照批准的生产工艺组织生产、改变生产工艺不按规定研究和申报。为此,总局决定开展药品生产工艺核对工作。现就有关事项公告如下:
一、药品生产企业(含境外制药厂商,下同)作为承担药品质量第一责任人安全的主体责任,必须严格按照食品药品监管部门核准批准的生产工艺组织生产。药品生产企业改变已批准的生产工艺,必须经过充分的研究和验证,并按照《药品注册管理办法》的有关规定提交药品注册补充申请。
二、自本公告发布之日起,药品生产企业应对每个批准上市药品的生产工艺(中药为制法,下同)开展自查,排除质量安全隐患。
二、三、自查内容为药品的实际生产工艺与报经食品药品监管部门核准批准的生产工艺是否一致。食品药品监管部门核准批准的生产工艺包括批准审批药品生产申请时核准批准的生产工艺及批准审批相关补充申请时核准批准的生产工艺。
三、四、药品生产企业应于2016年10月1日前完成自查并将自查情况报所在地省级食品药品监管部门。省级食品药品监管部门应对企业自查情况进行汇总,填写自查情况汇总表(附件1)并于2016年11月1日前上报食品药品监管总局。
五、药品生产企业根据自查结果,应分别采取以下处理措施。:
(一)实际生产工艺与核准批准生产工艺一致,、能够保证药品质量的,相关药品生产企业可以继续生产或进口,并应将自查情况报告与药品生产工艺报所在地省级食品药品监管部门备案;进口药品生产工艺报食品药品监管总局受理与举报中心(以下简称“受理中心”)备案,受理中心应在受理后5日内将申报等资料送交食品药品监管总局审核查验中心一并归档,作为监管部门开展日常监管、现场核查的备查资料。
(二)实际生产工艺与核准批准生产工艺不一致的,应立即停止生产或进口。相关药品生产企业应按照《药品生产质量管理规范》《药品注册管理办法》补充申请事项的相关要求以及《已上市中药变更研究技术指导原则(一)》、《已上市化学药品变更研究的技术指导原则(一)》、《生物制品生产工艺过程变更管理技术指导原则》等相关技术要求开展充分的研究验证。
1.经研究验证,生产工艺变化对药品安全性、有效性和质量可控性不产生影响的,药品生产企业应将生产工艺及相关资料报所在地省级食品药品监管部门备案后方可继续生产,进口药品生产工艺报食品药品监管总局受理中心备案后方可继续进口。受理中心应在受理后5日内将申报资料送交食品药品监管总局审核查验中心。
2.经研究验证,生产工艺变化对药品安全性、有效性和质量可控性质量不产生影响的,药品生产企业应按照《药品注册管理办法》附件4的要求第18项提出“改变影响药品质量的生产工艺”补充申请,申报资料要求见附件2。省级食品药品监管部门或食品药品监管总局受理与举报中心于受理后无需实施现场核查及抽样检验,并于5日内将申报资料送交国家食品药品监督管理总局药品审评中心(以下简称“药审中心”)。药审中心应在收到药审中心依据《药品注册管理办法》开展技术审评,必要时可以要求申请人补充资料,所需时间不计入技术审评时限。国家食品药品监督管理总局依据《药品注册管理办法》作出审批决定。
经研究验证,生产工艺变化对药品质量产生影响的,企业应立即停产。药品生产企业应按照《药品注册管理办法》附件4第7项提出“改变影响药品质量的生产工艺”补充申请。省级食品药品监管部门于受理后5日内将申报资料送交药审中心。药审中心应组织专门审评力量、建立单独审评通道,于收到申报资料后30日内完成技术审评,必要时可以要求申请人补充资料,所需时间不计入技术审评时限。国家食品药品监督管理总局应在5日内完成行政审批。补充申请获批后,药品生产企业方可继续生产或进口。
四、药品生产企业应于2016年12月31日前完成上述自查、2017年6月30日前完成在产品种生产工艺的研究验证、提交备案或补充申请等相关工作,其他暂不生产品种应于2017年12月31日前完成上述工作;未按时完成的,应暂停生产或进口。国产药品和进口药品的生产工艺备案分别按照《药品注册管理办法》附件4的补充申请事项第36项和第18项提交,申报资料要求见附件1停止生产。
五、2017年3六、2016年11月1日起,国家食品药品监督管理总局将组织专家对药品生产企业开展飞行检查。检查中发现实际生产工艺与食品药品监管部门备案或核准批准的生产工艺不一致的,其所生产的药品按假药论处,将依据《中华人民共和国药品管理法》第七十三第四十八条第二款的有关规定,其所生产的药品按假药论处。药监部门将依据《中华人民共和国药品管理法》第七十四条的有关规定对涉事药品生产企业进行处罚,并向社会公开相关药品生产企业企业法定代表人和相关责任人员。
六、依据《已上市中药变更研究技术指导原则(一)》、《已上市化学药品变更研究的技术指导原则(一)》、《生物制品生产工艺过程变更管理技术指导原则》,不影响安全性、有效性和质量可控性的变更,主要包括中药、化学药品I类和Ⅱ类变更,生物制品Ⅲ类变更。影响安全性、有效性和质量可控性的变更,主要包括中药、化学药品Ⅲ类变更,生物制品I类和Ⅱ类变更等。具体见附件2。七、发生过影响药品质量的生产工艺变更,但生产企业能够确保产品安全有效的,符合下列情形的,可以暂不停产,但需要按本公告要求提出相关补充申请。
(一)相关品种在《药品注册管理办法》2007年修订实施前已经发生影响药品质量的生产工艺变更,此后一直正常生产,生产工艺稳定且未发现安全性和有效性问题的;
(二)相关品种发生影响药品质量的生产工艺变更,变更后的生产工艺属于技术进步或创新的。
八、本公告自发布之日起实施,进口药品参照执行。
特此公告。
