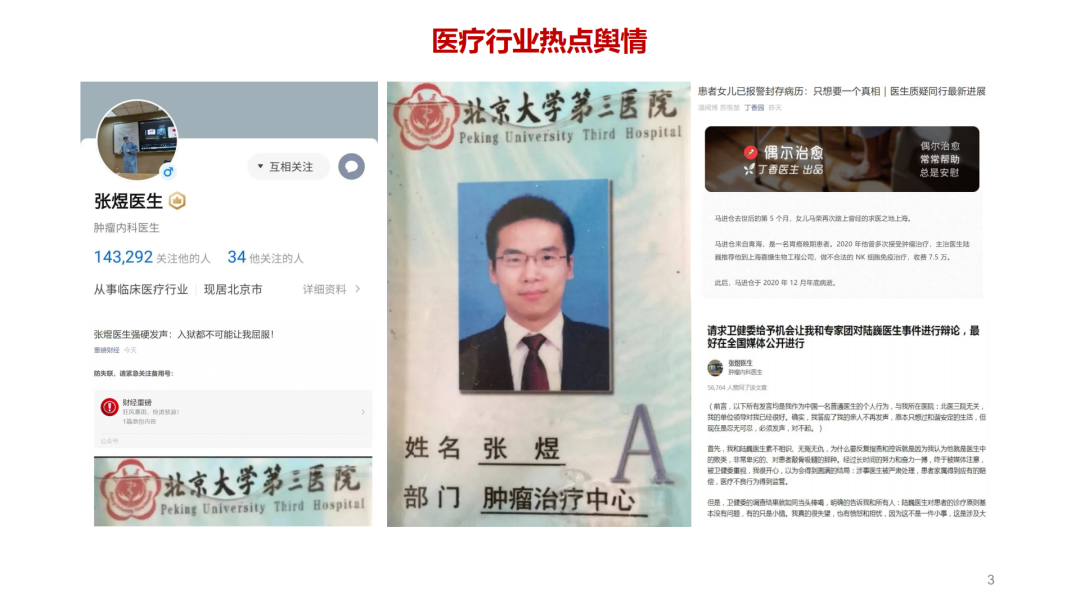
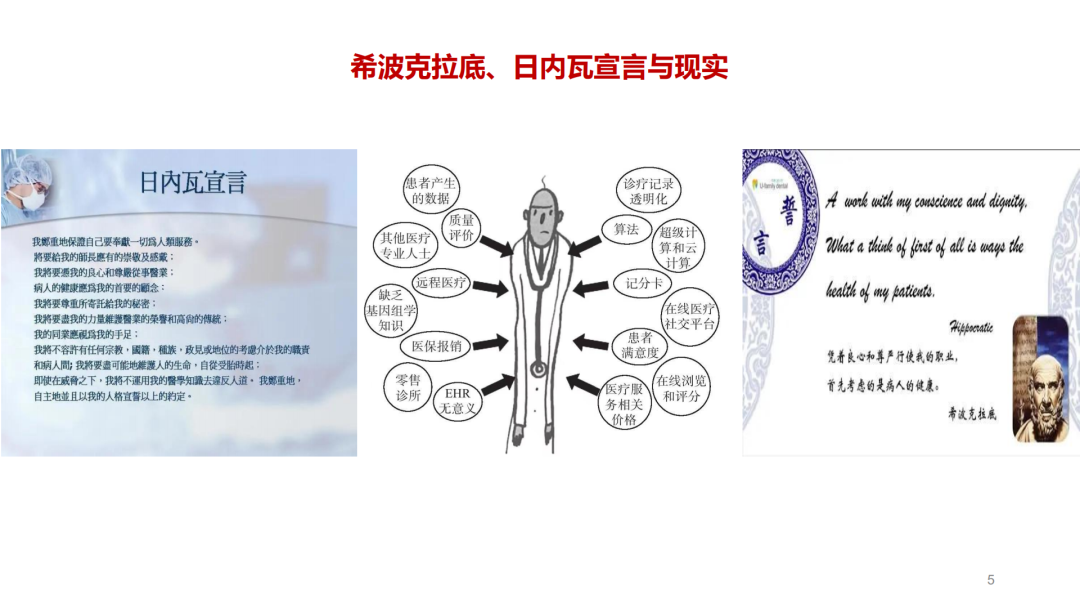
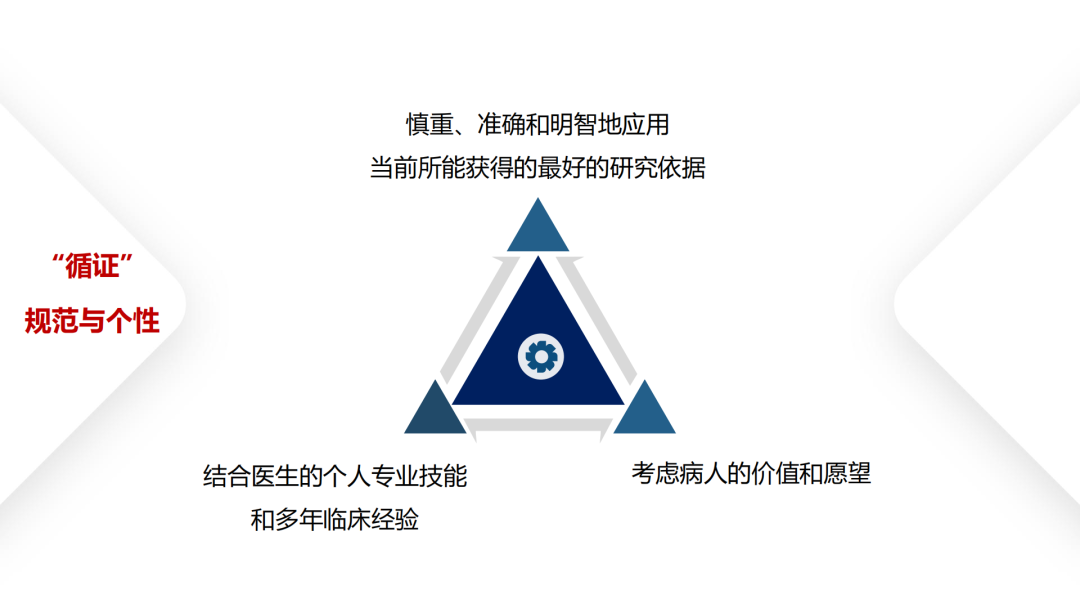
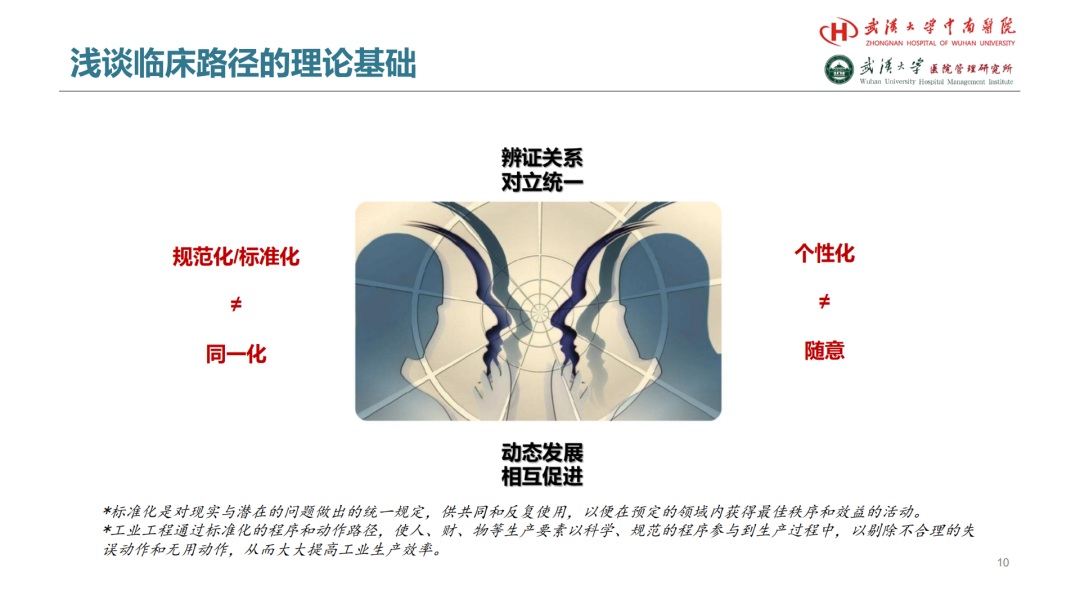
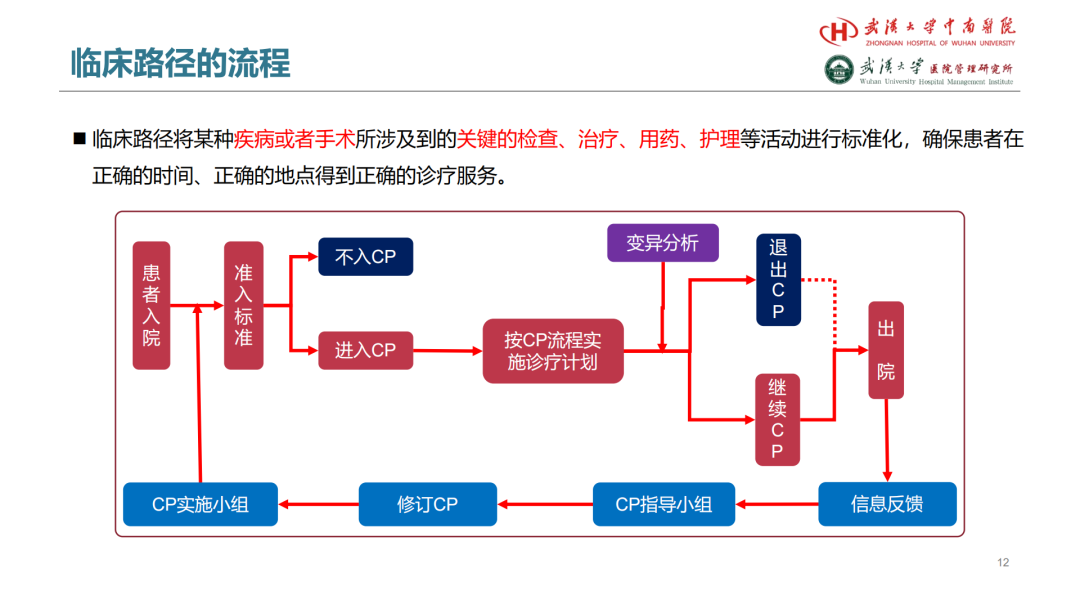
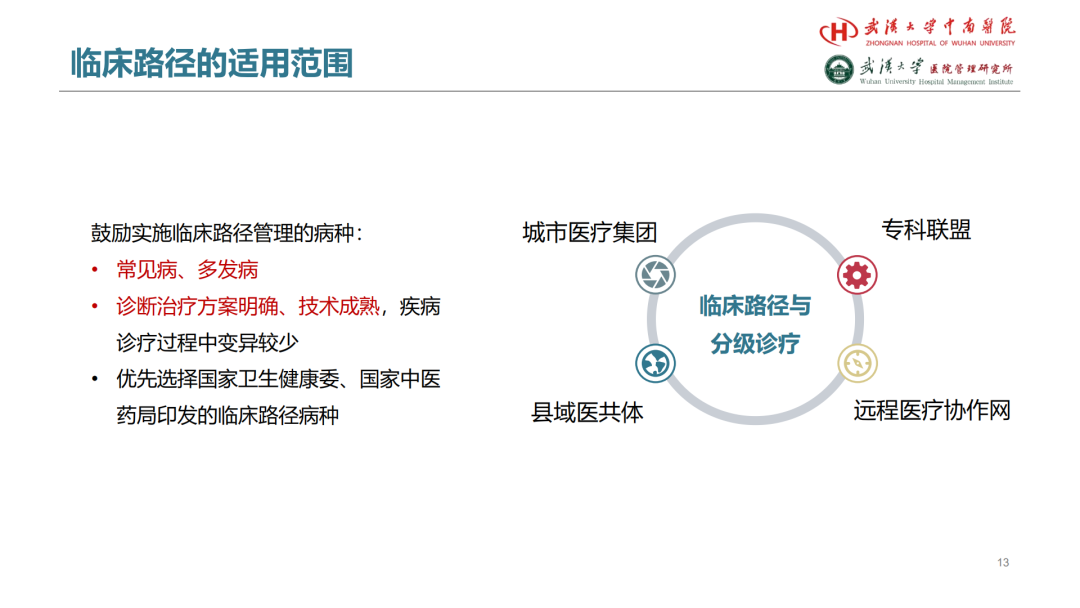
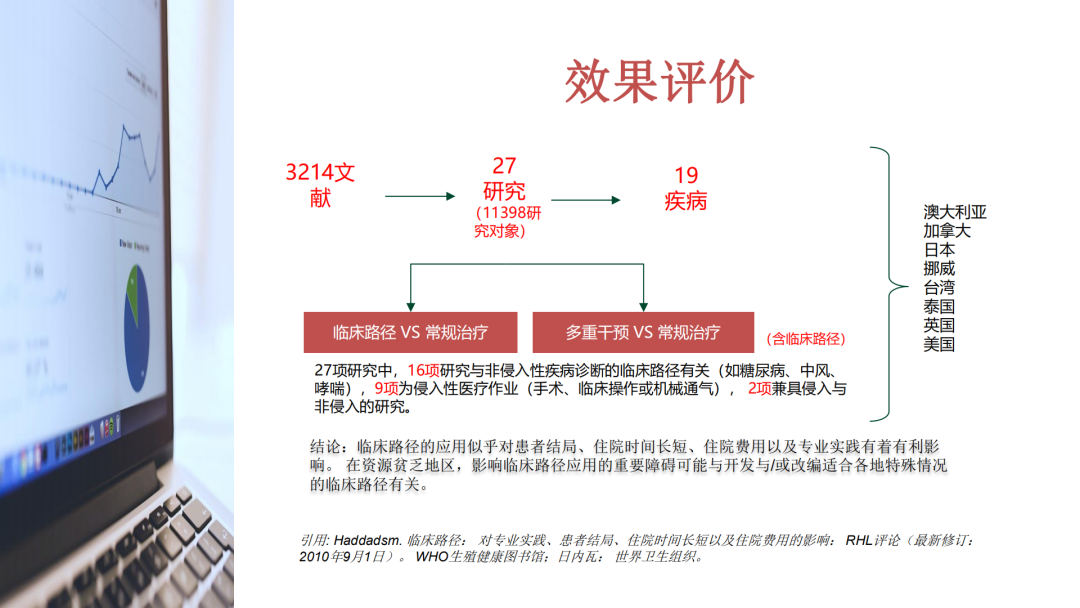
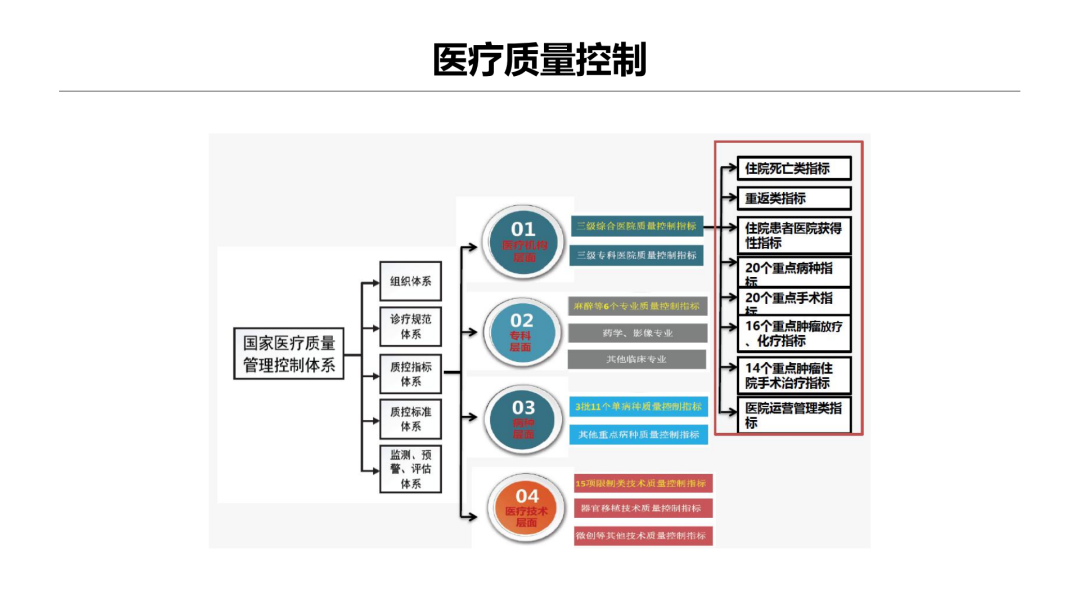
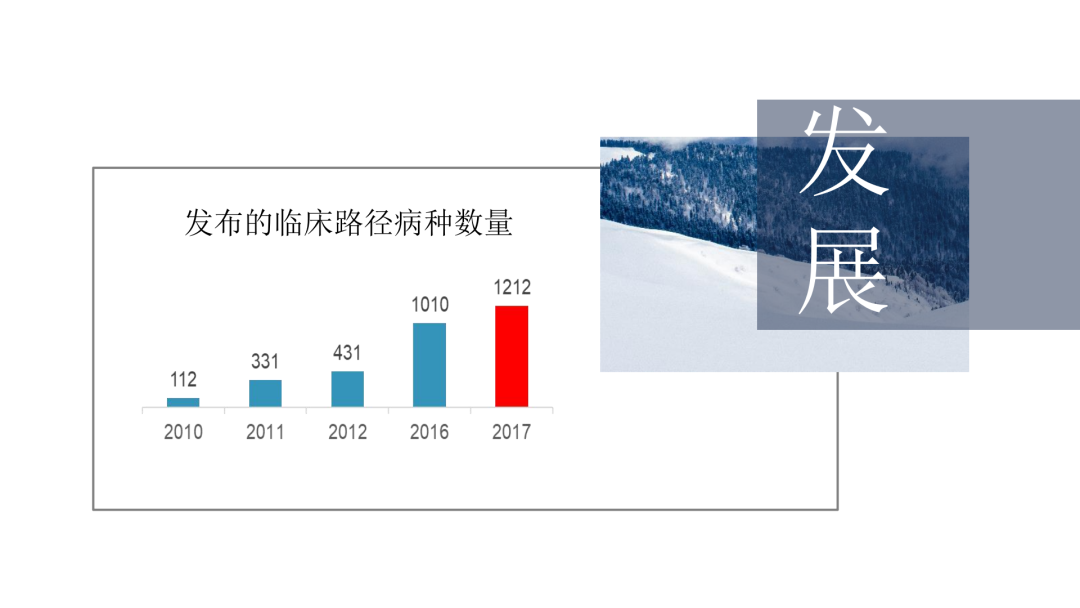
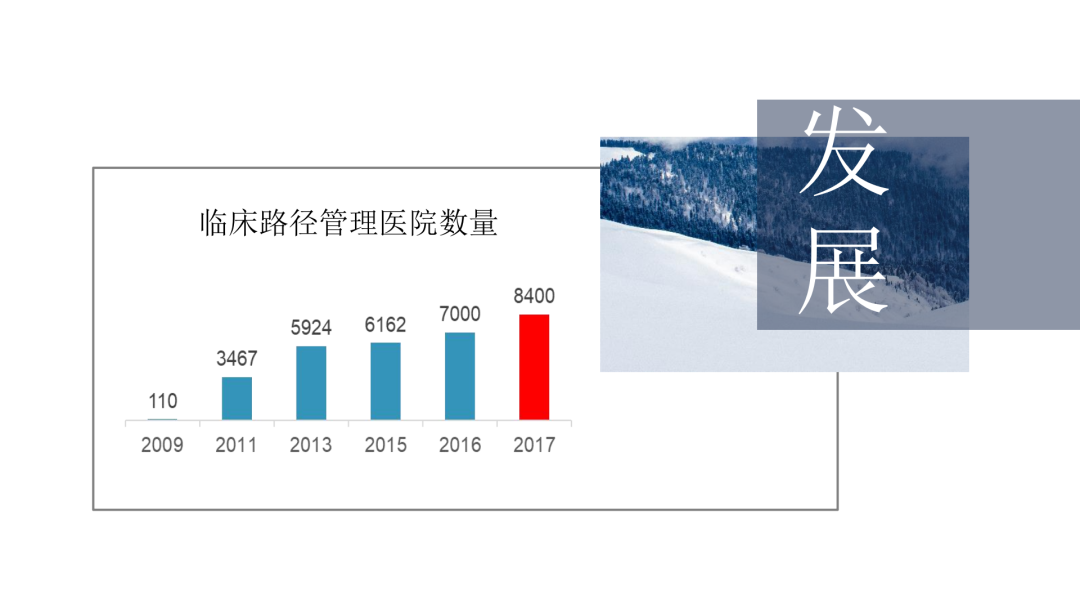
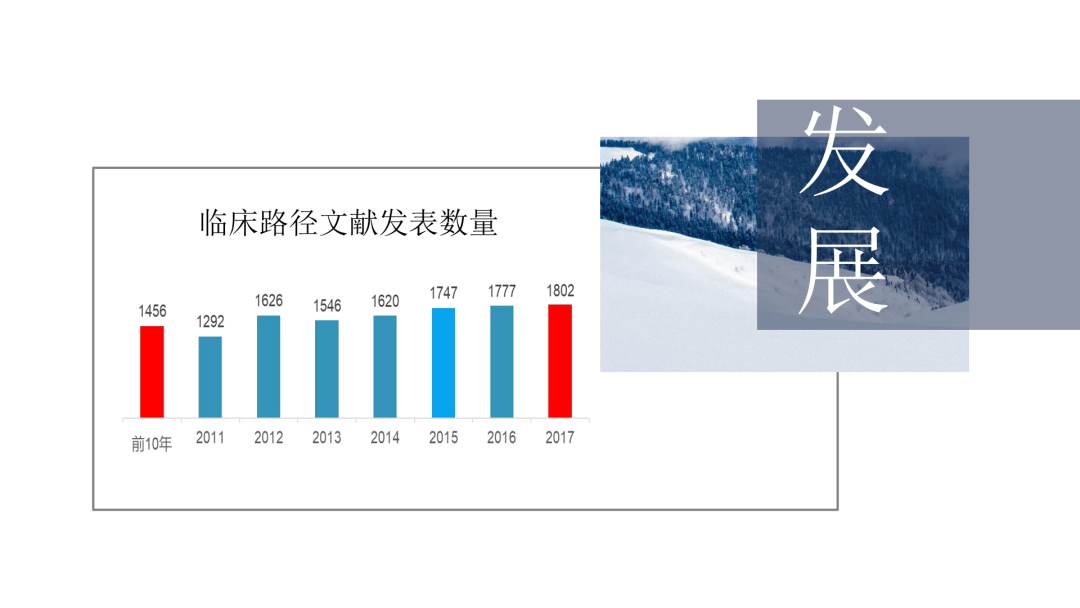
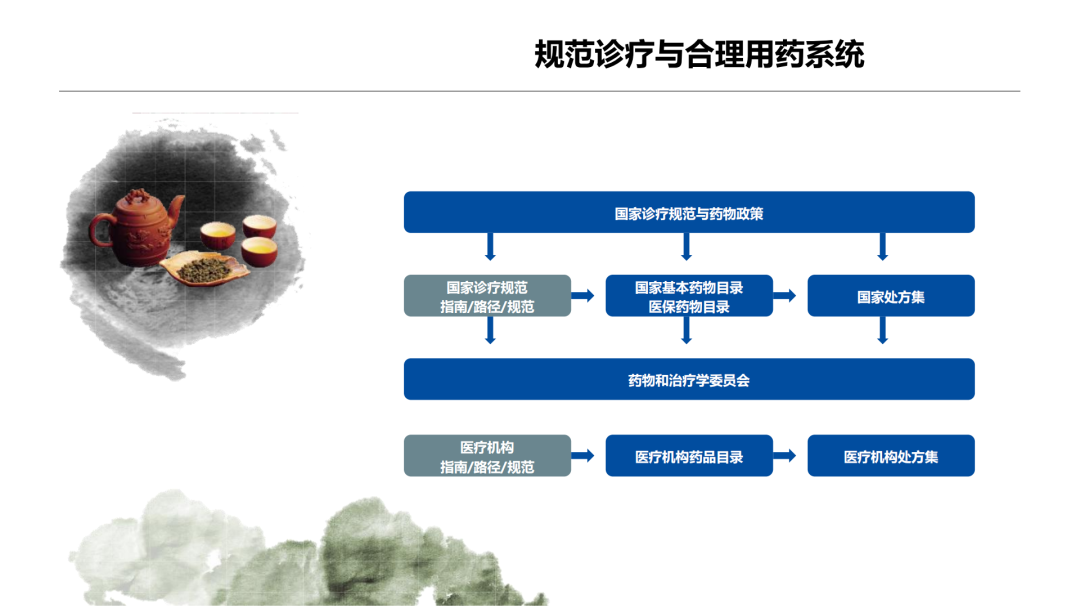
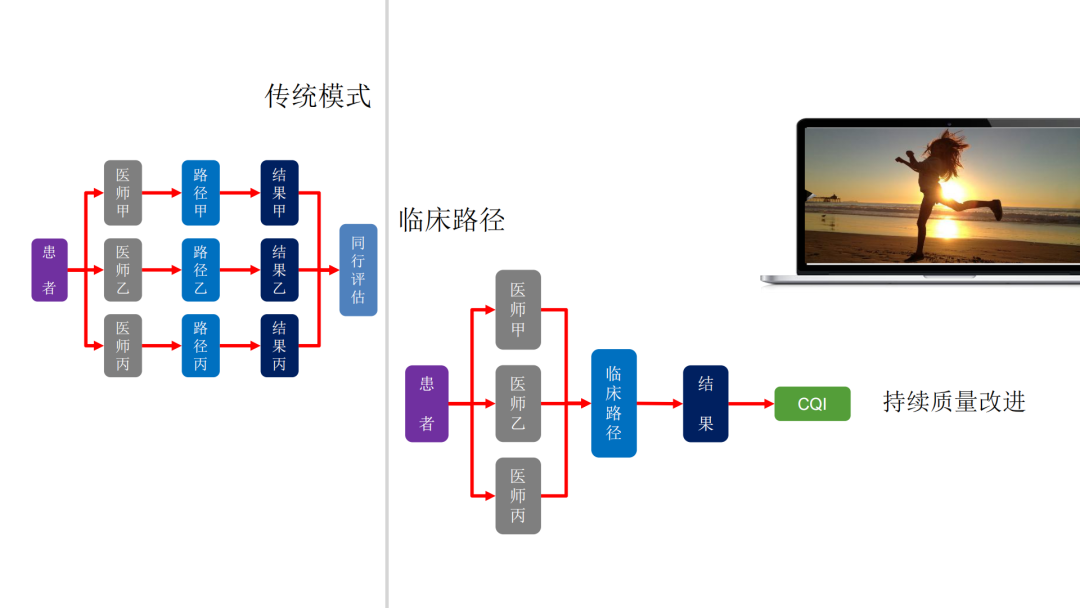
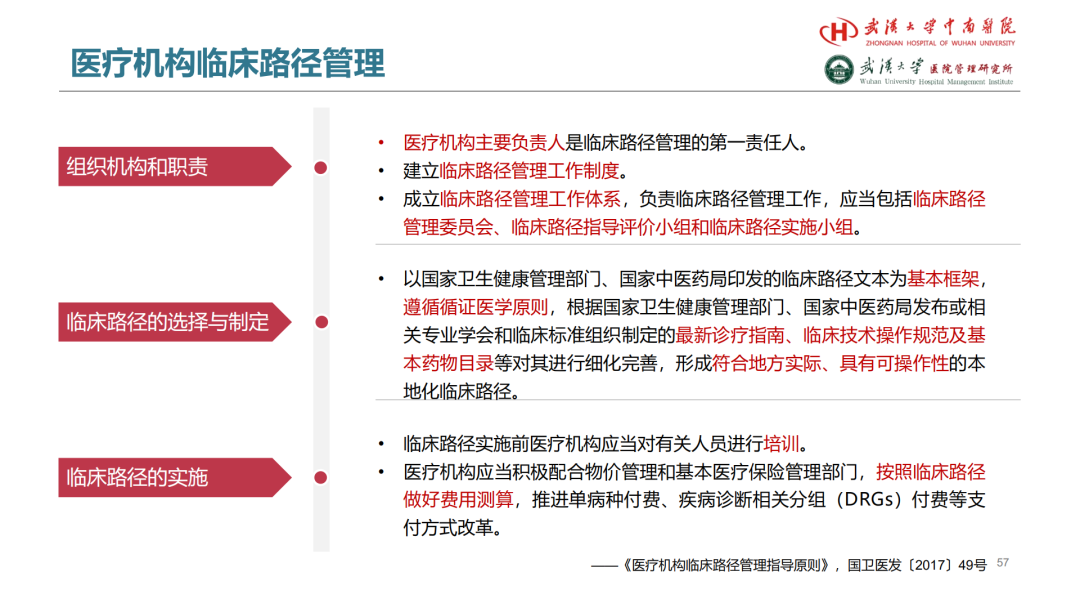
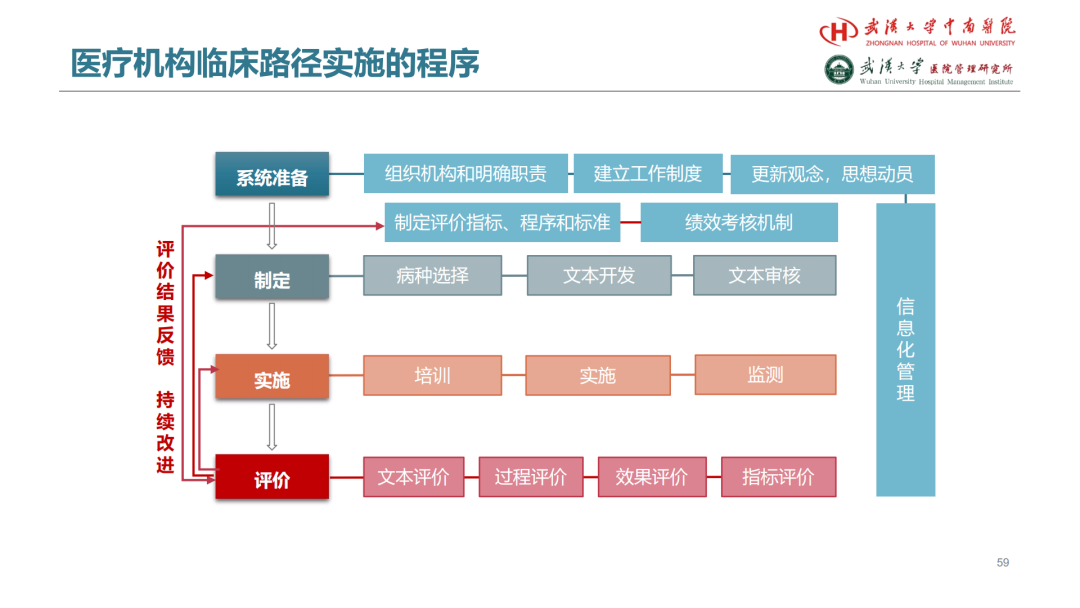
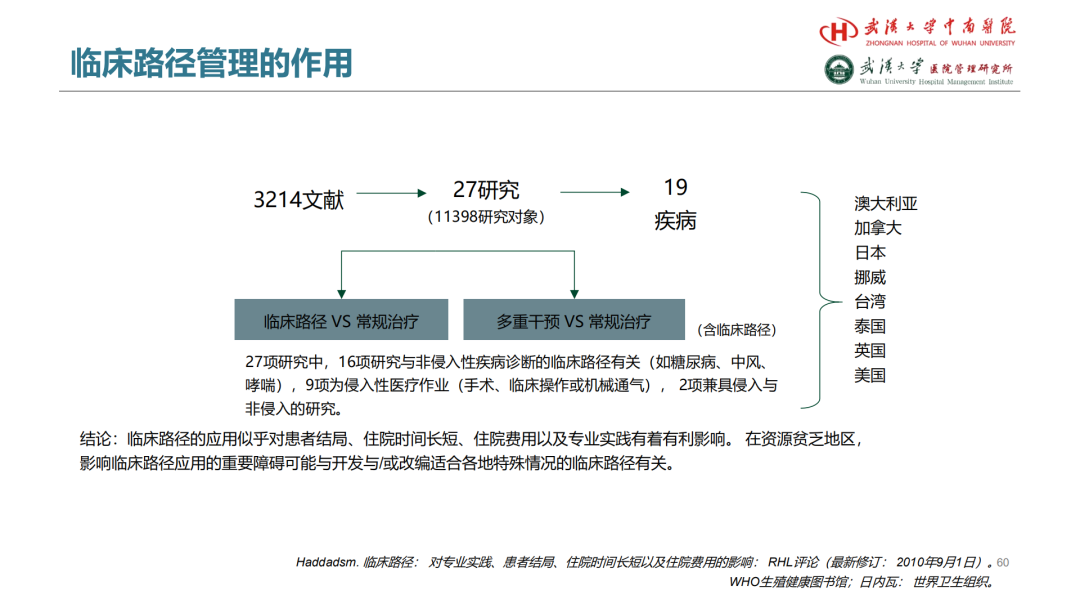
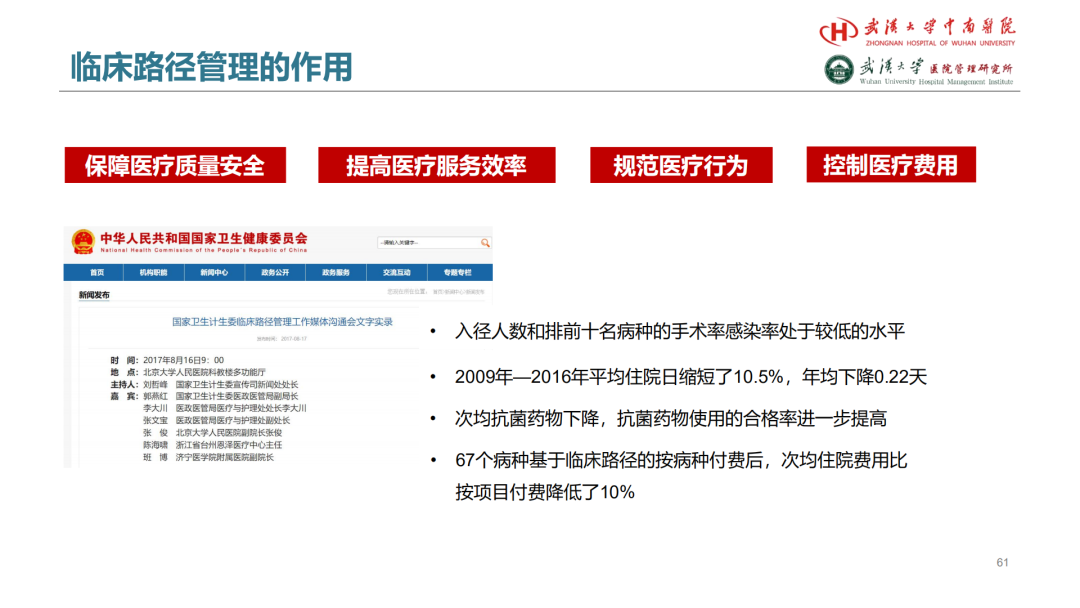
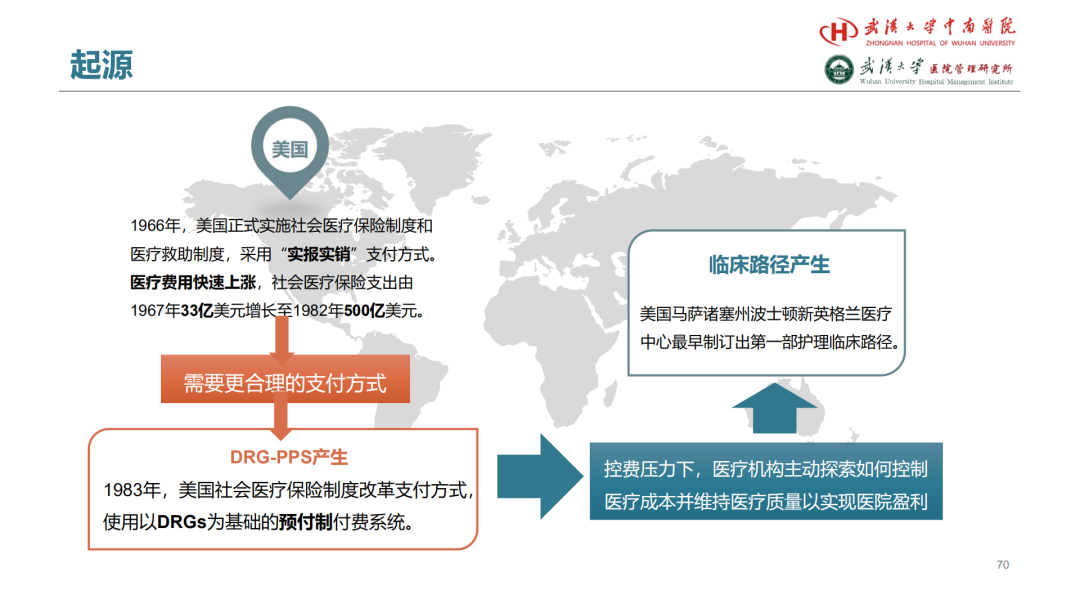
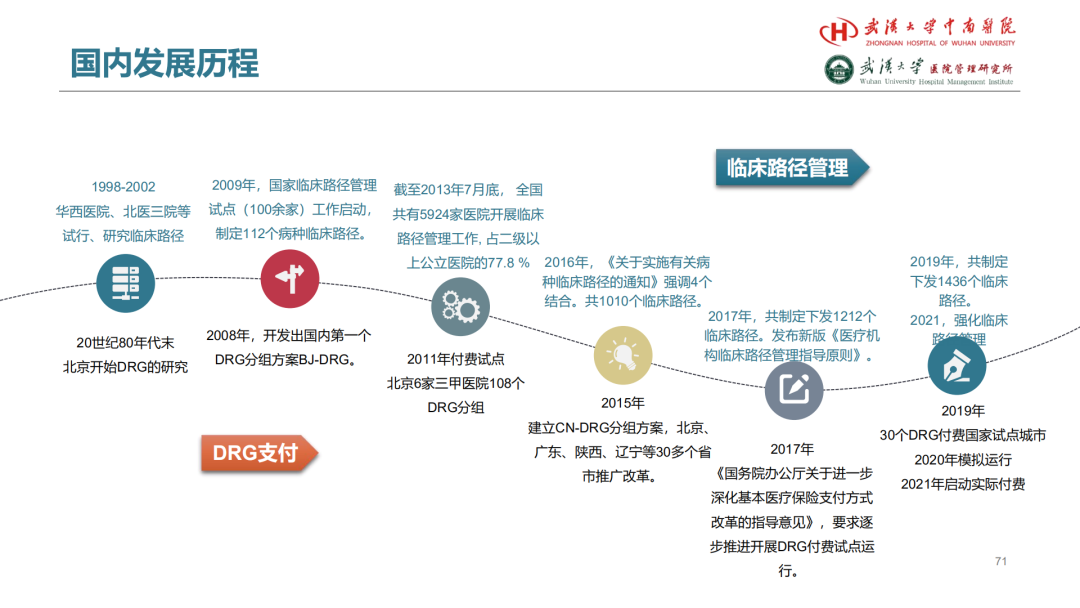
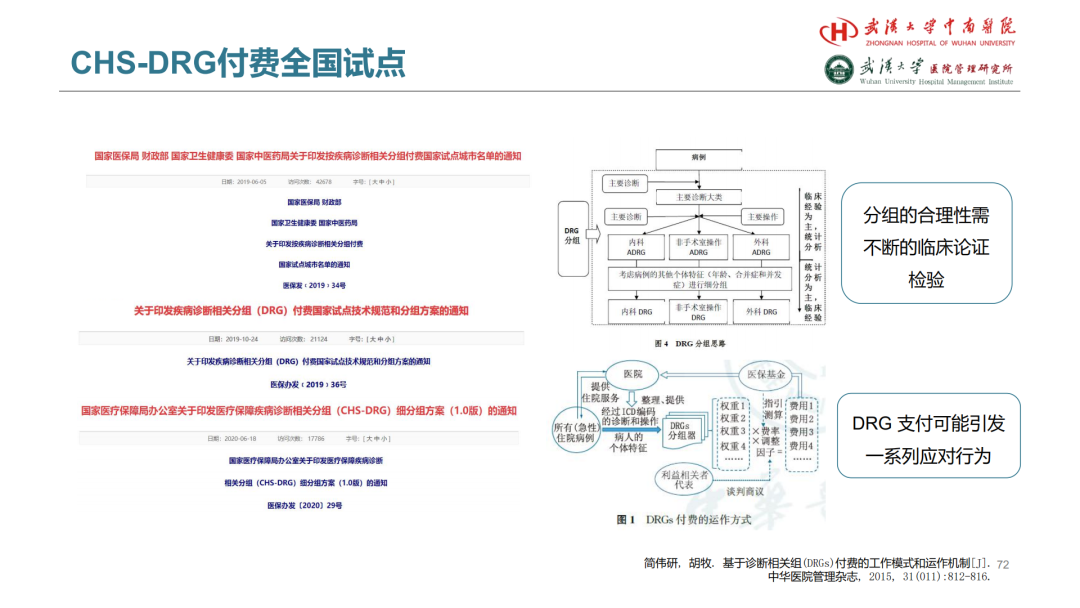
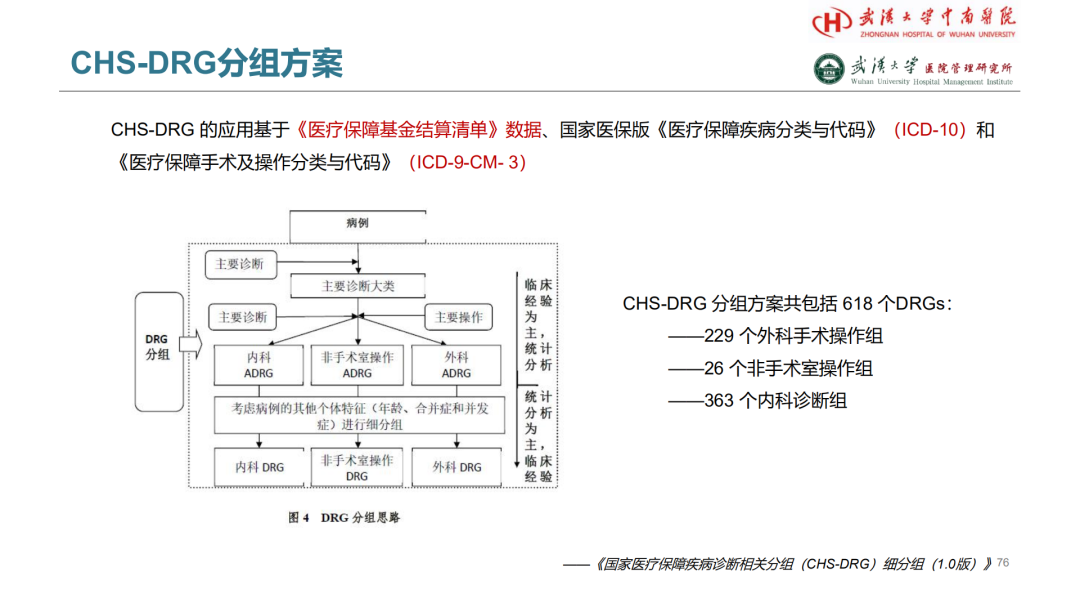
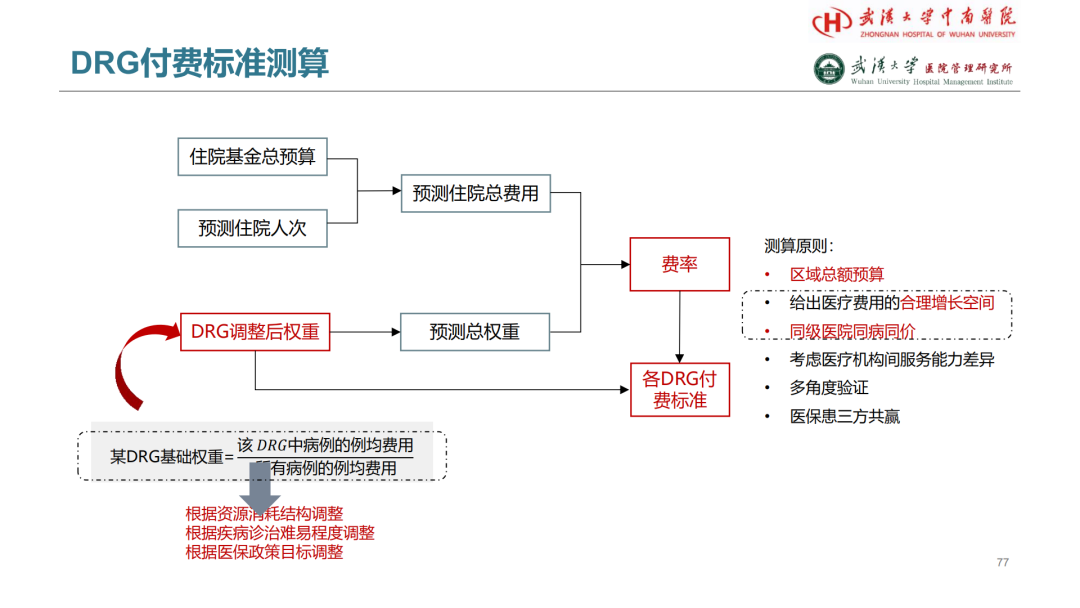
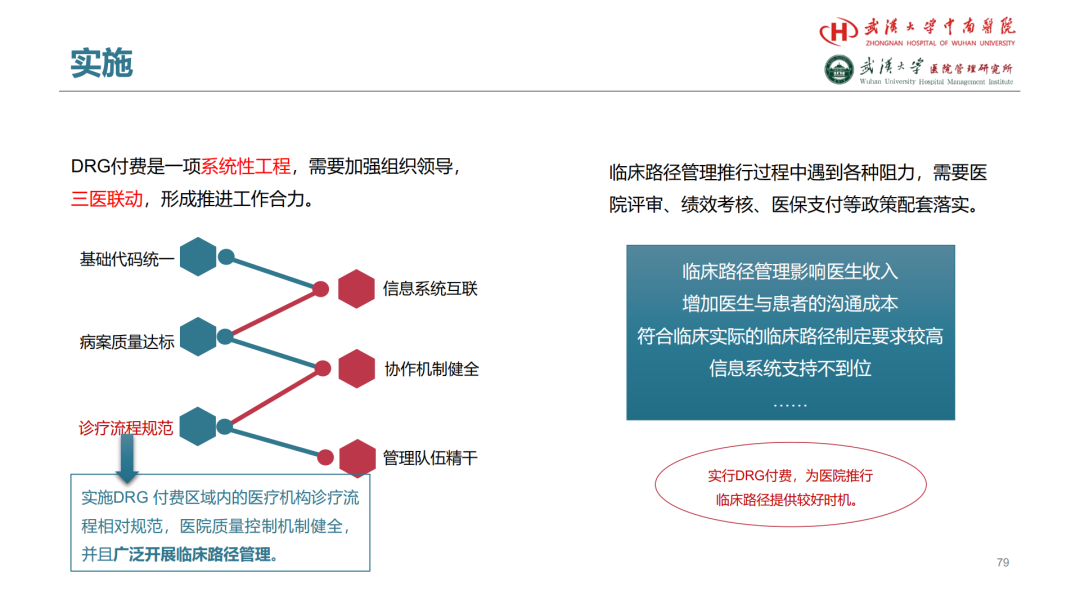
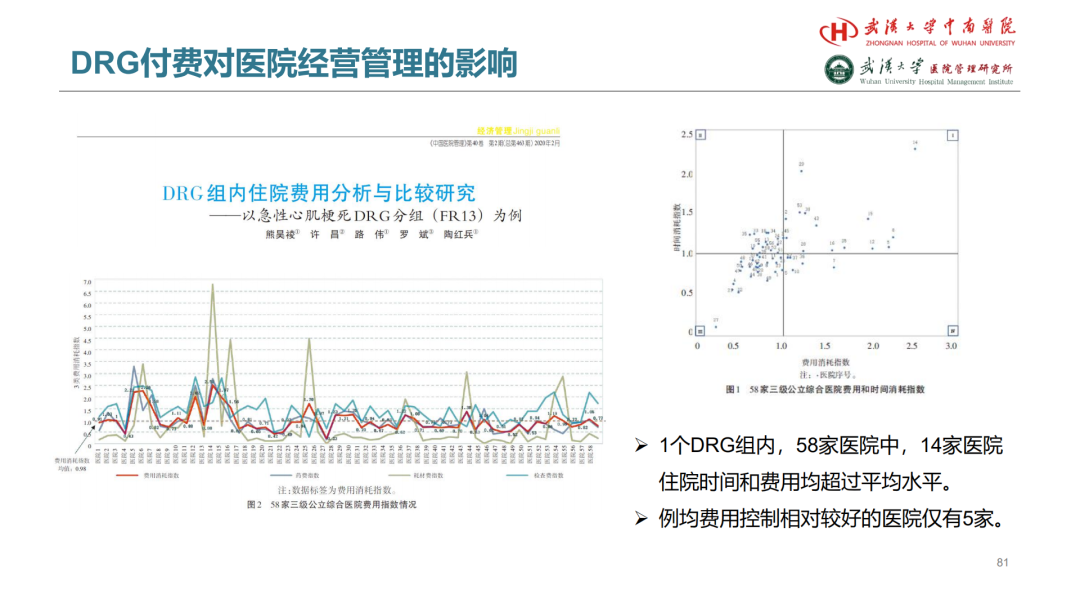
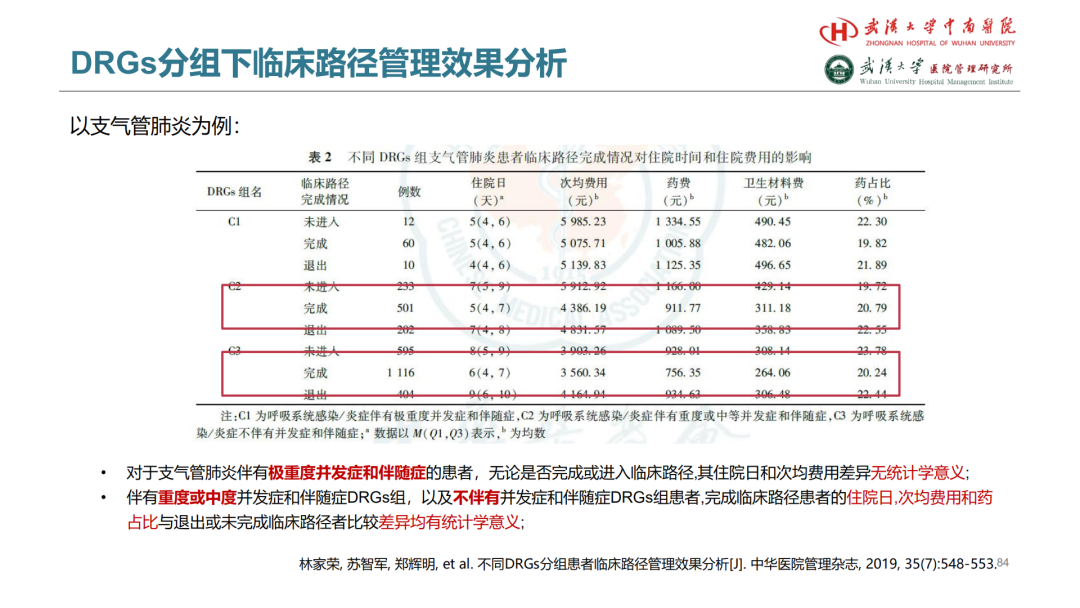
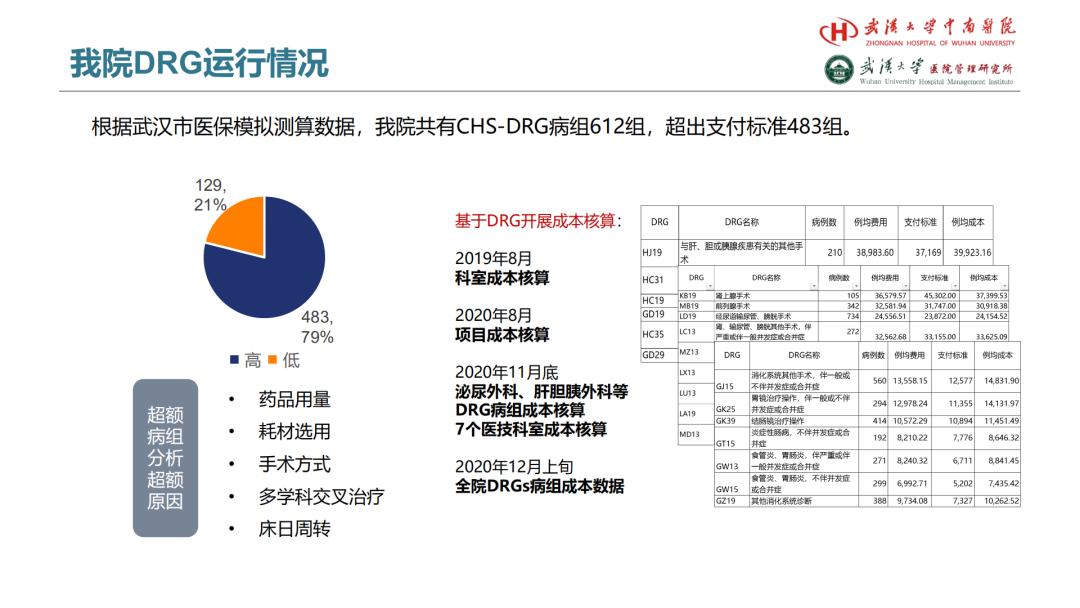
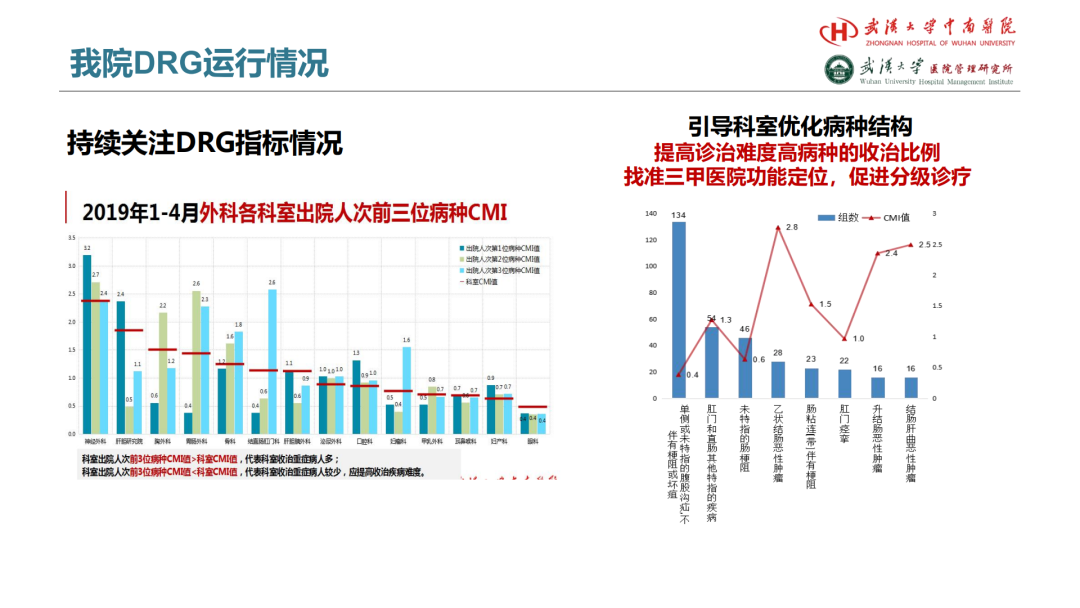
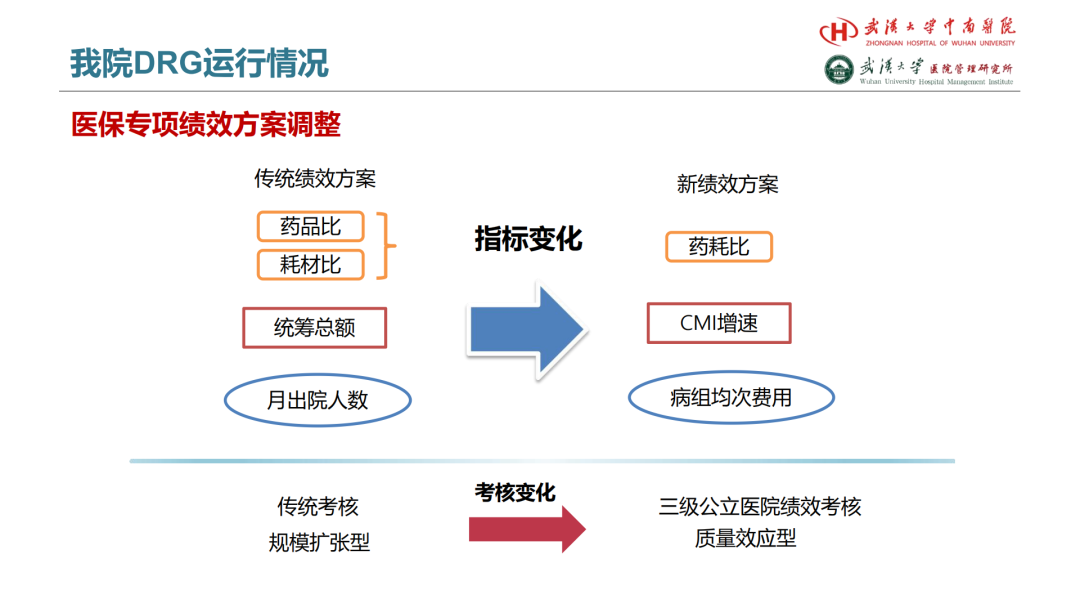
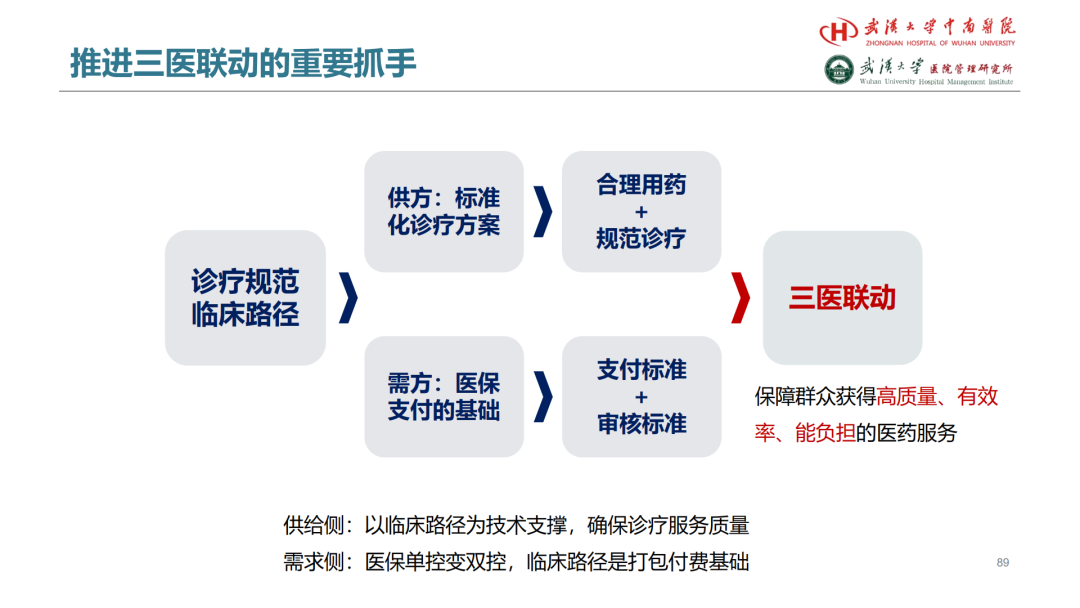
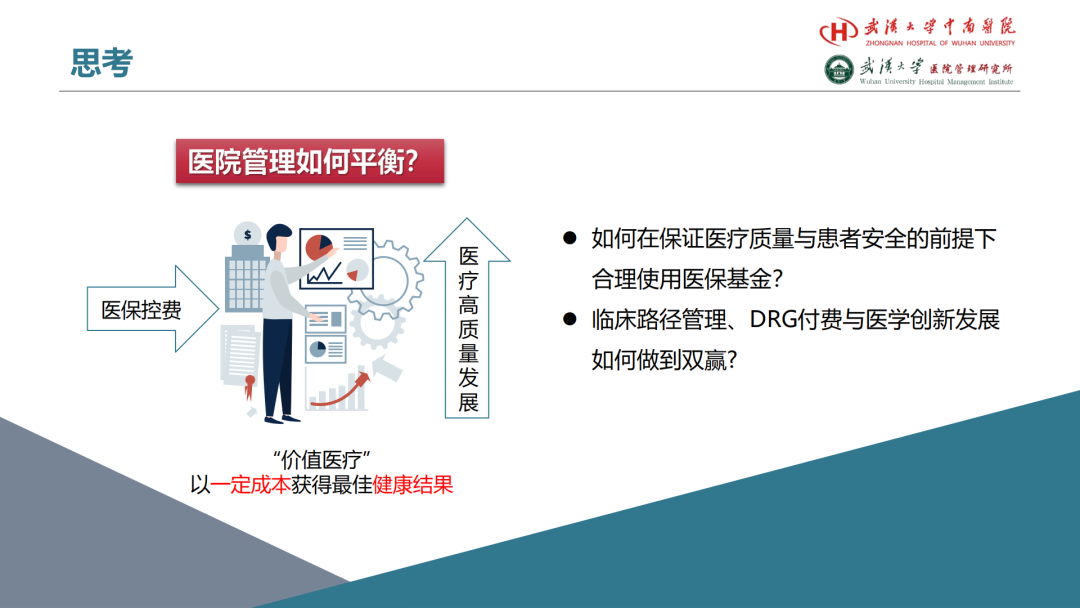
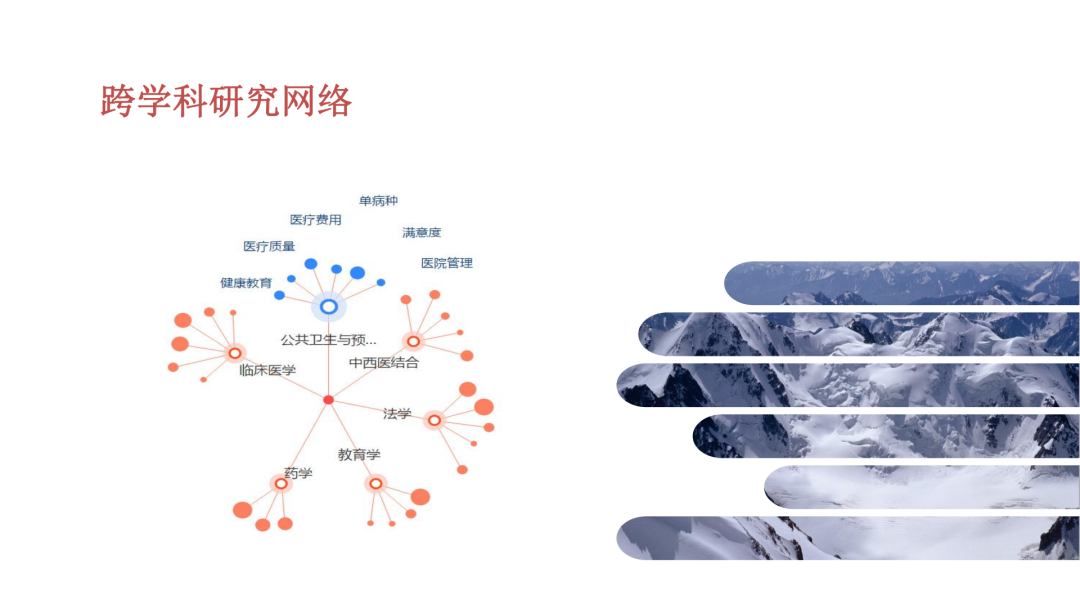
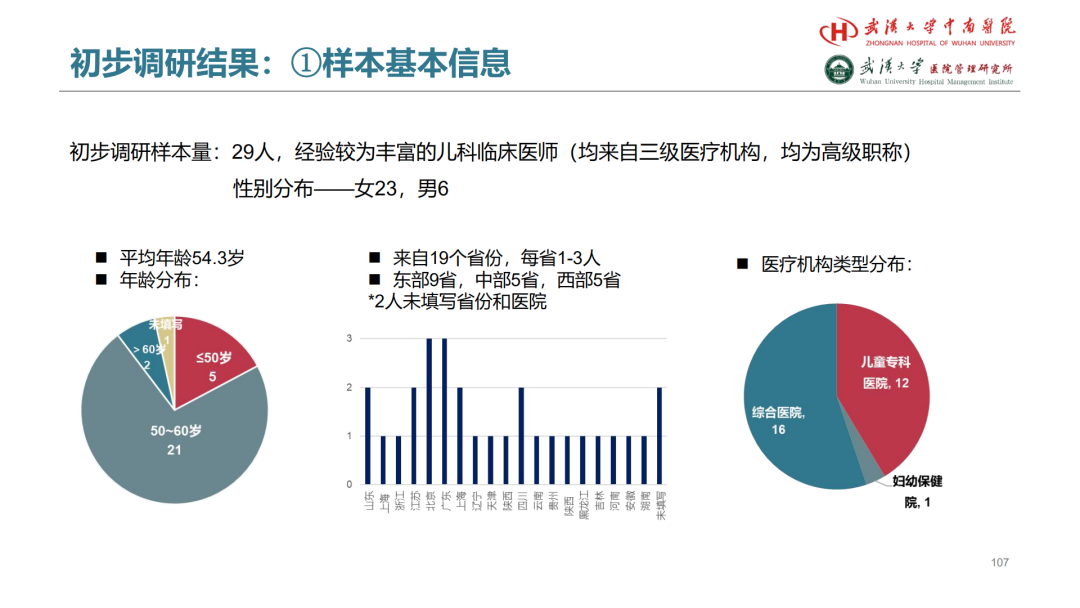
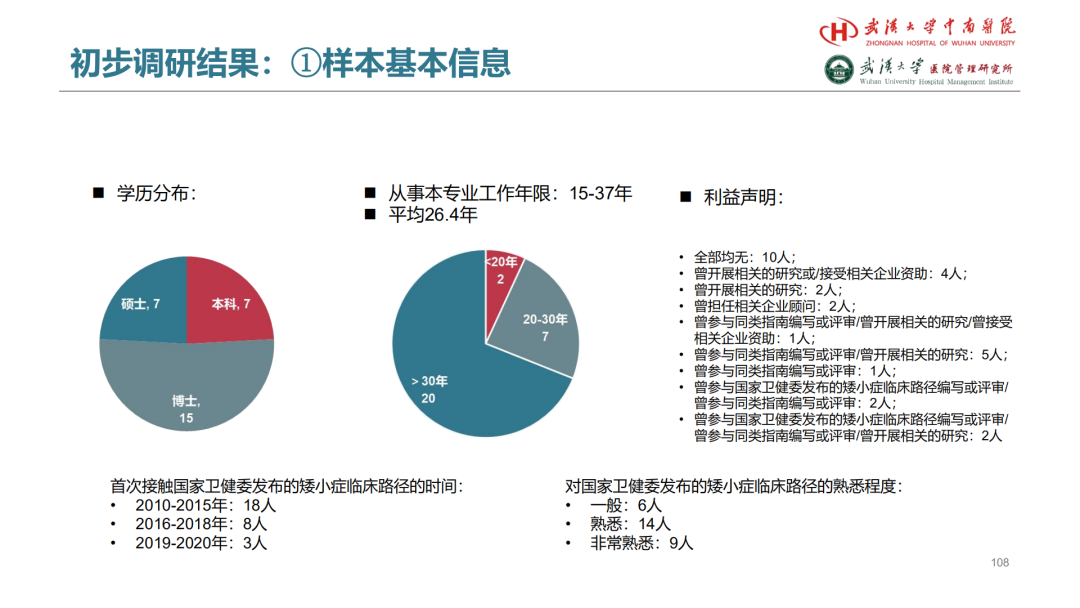
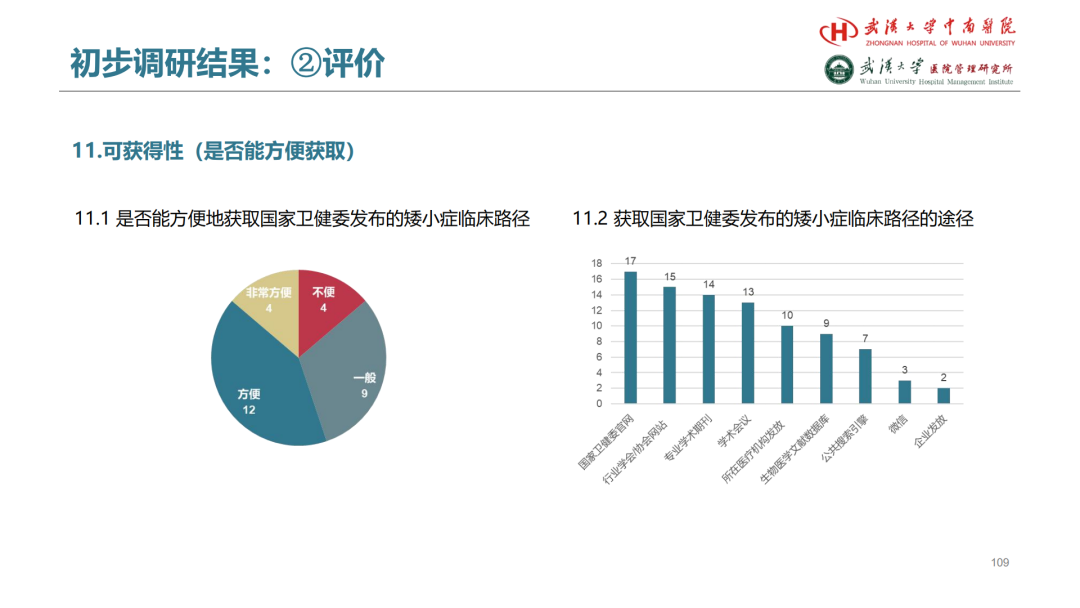
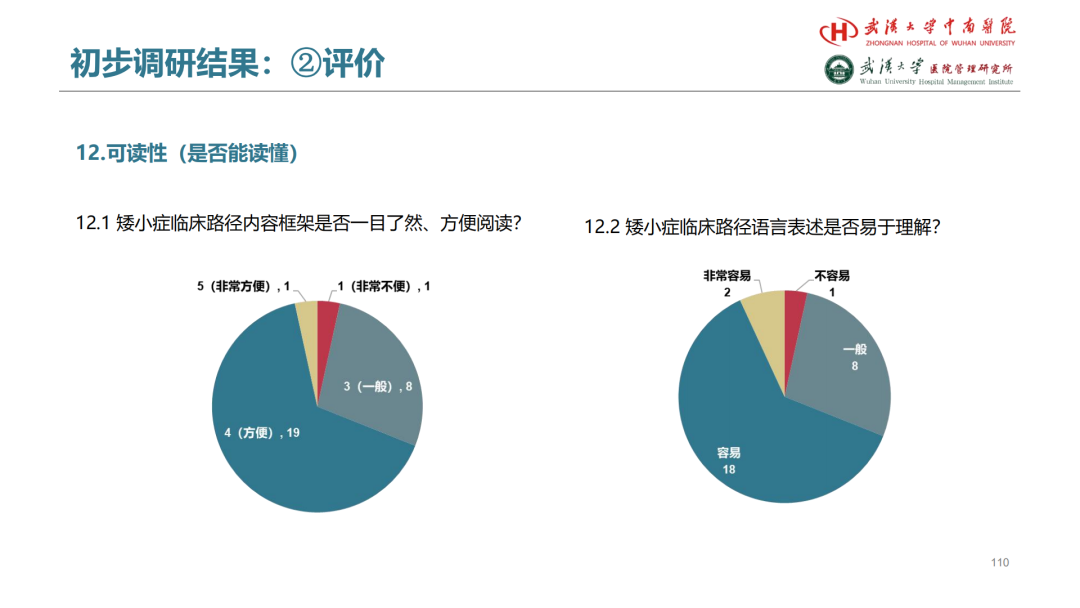
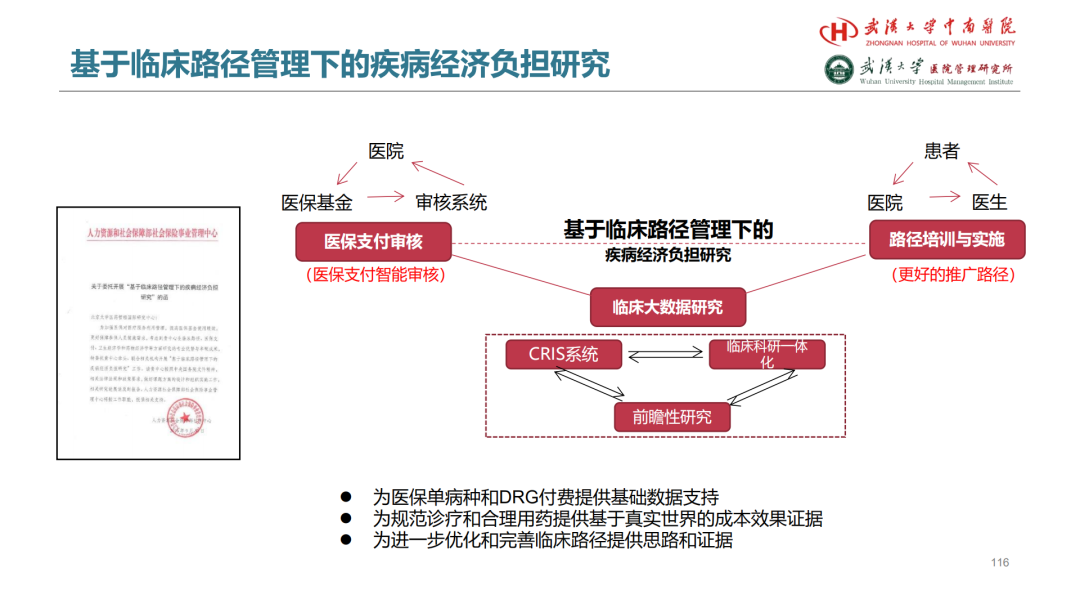
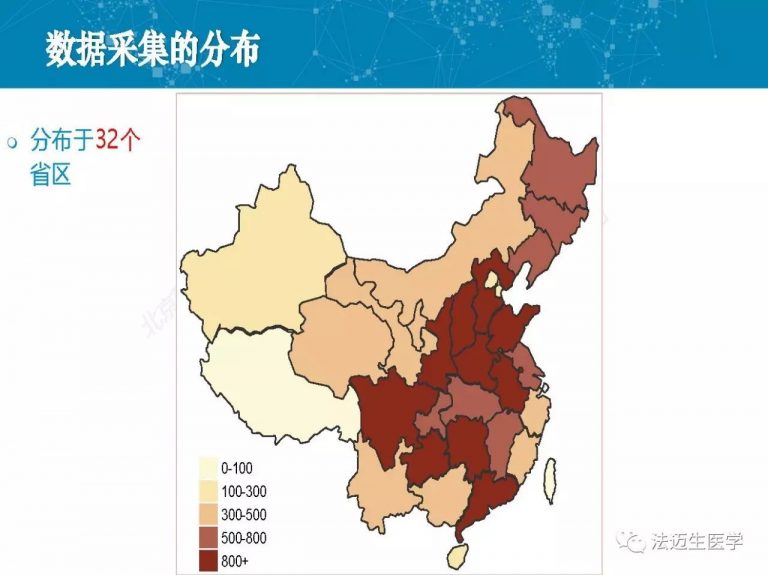
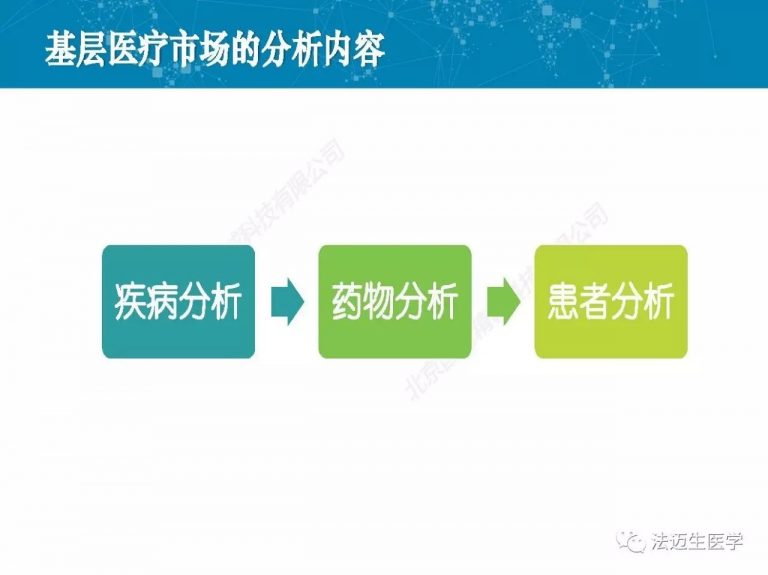
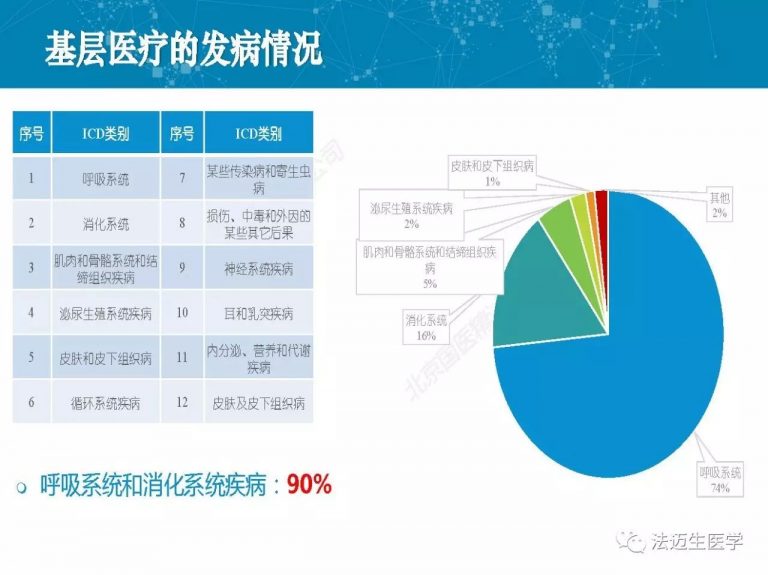
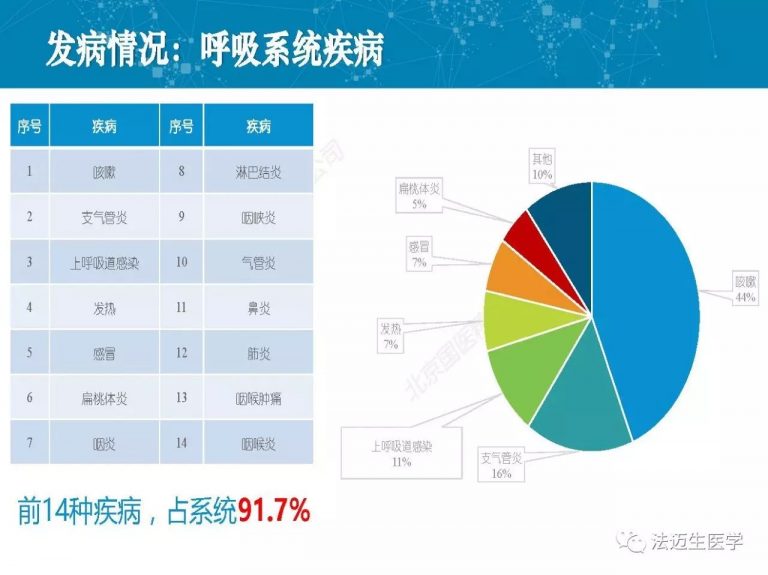
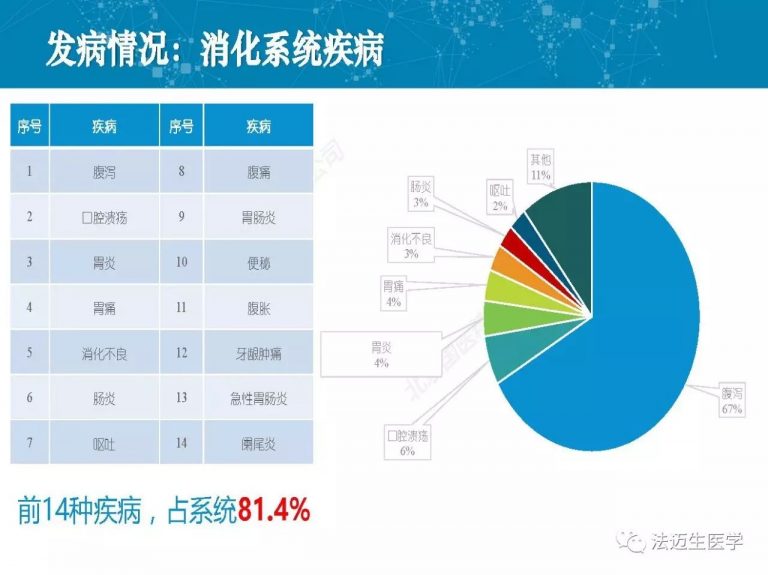
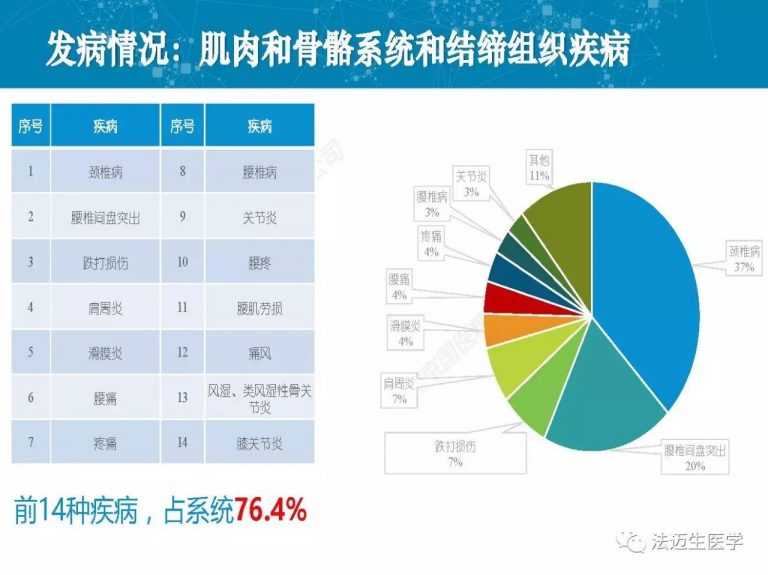
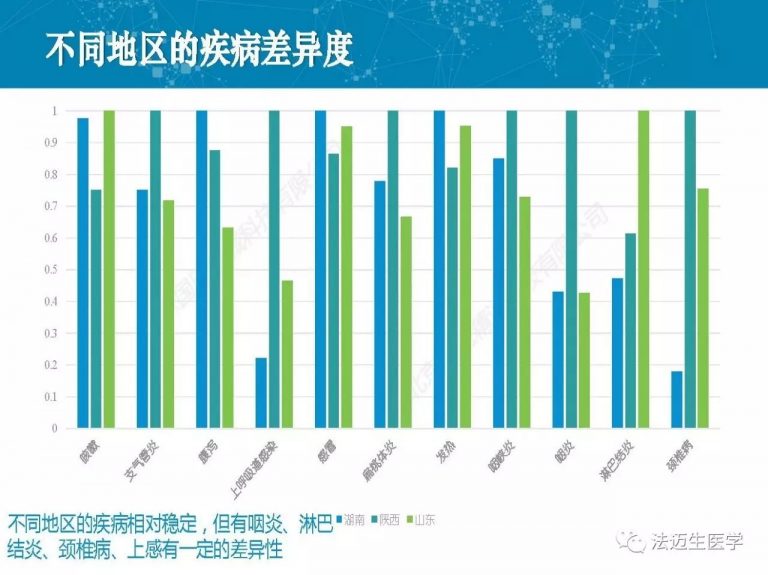
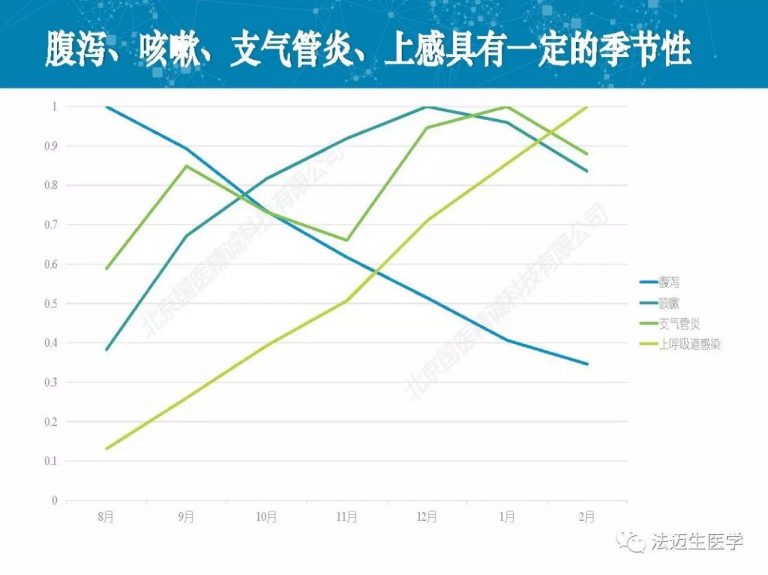
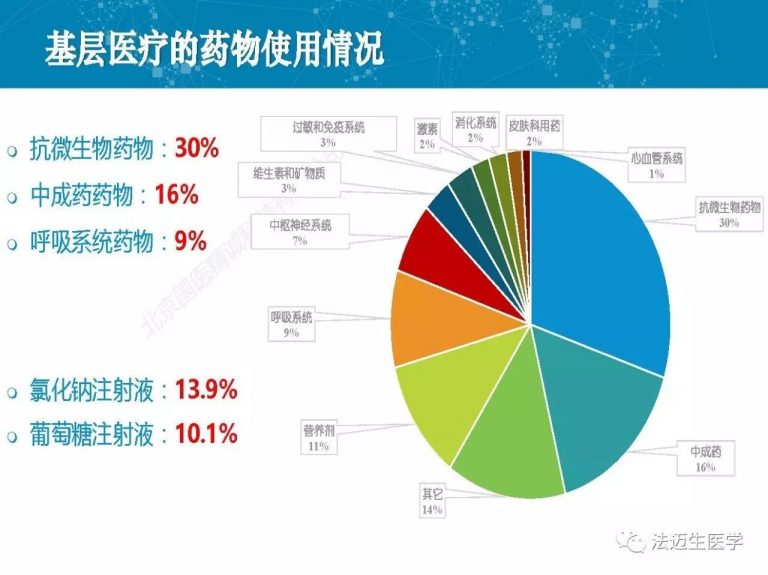
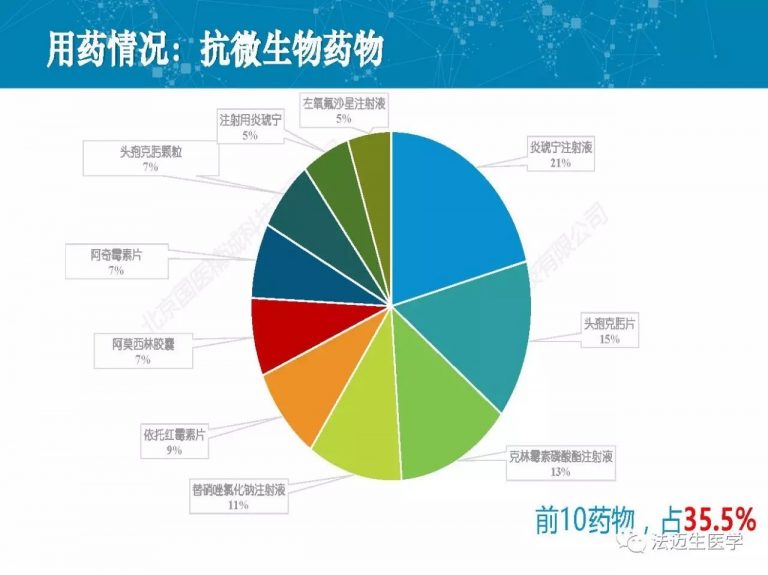
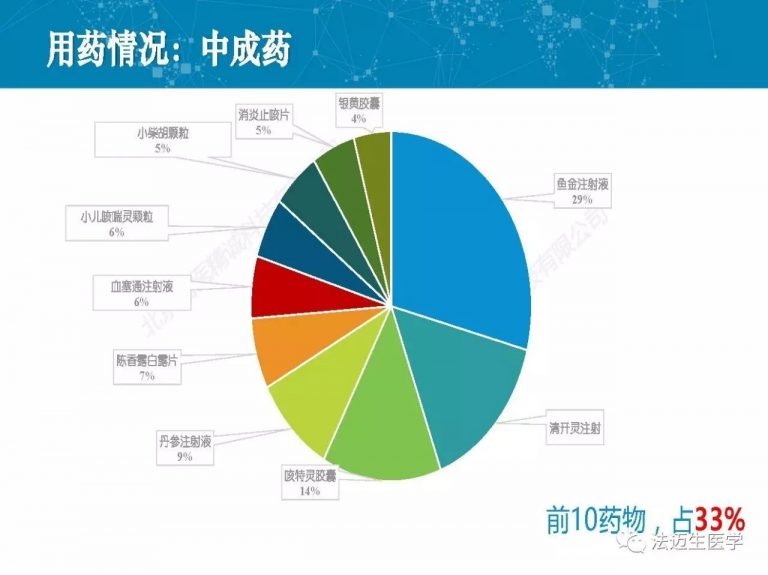
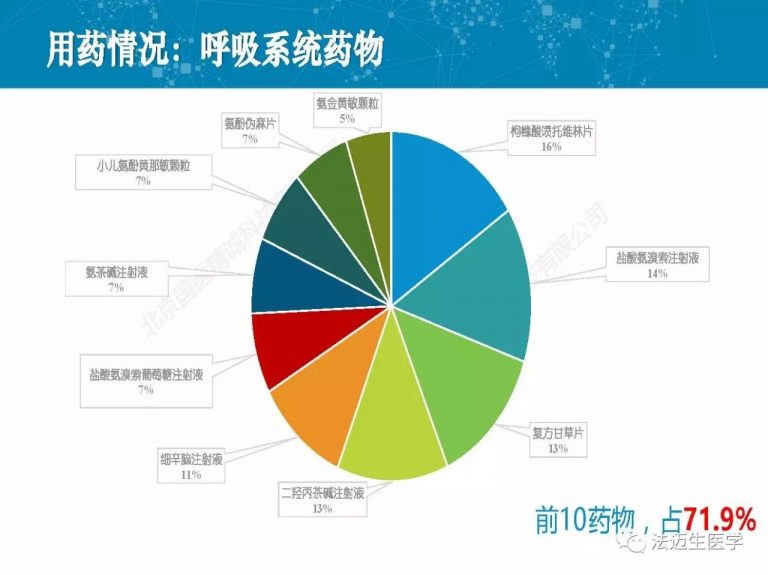
试论真实世界研究与人用经验在中药新药研发中的应用
杨忠奇1 汤慧敏1 唐雅琴1 杜彦萍1 高蕊2 胡思源3 元唯安4 邹冲5 丁红6 赵艳玲7
1. 广州中医药大学第一附属医院 2. 中国中医科学院西苑医院 3. 天津中医药大学第一附属医院4. 上海中医药大学附属曙光医院 5. 江苏省中医院 6. 成都中医药大学附属医院 7. 湖南中医药大学第一附属医院
真实世界研究(real world study, RWS)是指针对预设的临床问题,在真实世界环境下收集与研究对象健康有关的真实世界数据,通过分析获得药物的使用情况及潜在获益/风险的过程,其数据来源于卫生信息系统、医保系统、疾病登记系统和药品不良反应监测系统等。中药人用经验是2015年药物临床试验数据核查后,中药新药研发陷入低谷背景下,专家通过总结中药新药临床试验中存在问题后提出的新理念,其数据来源包括某些真实世界数据,更多是要收集中药新药处方形成、理法方药和临床应用情况等关键要素。RWS主要是用于药品上市后不良反应监测、上市药品效益评估与医疗、医保决策、特殊医疗器械和特殊药品监管审批决策,与临床随机对照试验是互补的关系。人用经验适用于中药复方制剂研发和增加功能主治,对于临床适应症和目标人群没有特殊规定,人用经验与临床试验是序贯衔接关系,通过总结人用经验为临床试验的设计与实施提供良好的支撑,是中药新药研发重要环节和普遍性方法。RWS关键在真实世界数据与研究结果的相关性和可靠性,要避免”真实世界研究不真实”。人用经验总结关键在于明确中药新药临床定位、适用人群、疗程、用法用量,避免”人用经验只讲临床经验”。在人用经验总结中采取RWS,通常采用试验性研究(pragmatic clinical trial, PCT);中药新药研发中RWS与人用经验是为了回答不同临床问题而产生的不同研究设计,研究者应根据实际情况选择合适方法。
近年来对真实世界研究(real world study, RWS)与人用经验在中药研发、审评与监管决策中的作用关注度日益增加,但RWS与人用经验在中药新药研发中的适用范围、临床适应症、目标人群、与临床试验关系均明显不同,下面简要论述RWS与人用经验在中药新药研发中的作用,厘清RWS和人用经验有关理念,以帮助研究者选择合适的研究方法。
1 真实世界研究
2 中药人用经验
3 真实世界研究与人用经验数据来源差异
4 真实世界研究与人用经验在中药新药研发中的不同作用
5 真实世界研究的关键
6 中药人用经验研究的关键
版权声明:文章来源自中国中药杂志. 2021,46(22);
本公号所刊载的文字、图片及其他素材,部分来源于网络,如有侵权,请联系我们删除。
蔡思雨 译
彭晓霞 校
首都医科大学附属北京儿童医院
临床流行病与循证医学中心
以患者为中心的疗效研究所(The Patient-Centered Outcomes Research Institute,PCORI)开发的定性和混合方法研究的方法学标准有助于确保研究的设计和实施可以产生人们所需的证据,来回答患者和临床医生关于哪种方法最有效,对谁最有效,在什么情况下最有效的问题。这套标准围绕以患者为中心的疗效研究的相关要素而制定,但也可为其他类型的临床研究提供指导。此标准可用于制定研究方案并对其进行评价、实施研究,以及解释研究结果。标准开发遵循系统的程序,即研究关键方法学问题的范围及其潜在标准,将范围缩小聚焦到最重要的标准上,起草标准初稿,征求同行专家组和广大公众的反馈意见,基于反馈意见确定标准终稿,供PCORI理事会审查并采纳。本文提供了一个例子,说明如何应用这些标准撰写研究计划书。
关键点
许多出版物就如何在健康研究中使用定性和混合方法研究提供了指南。
本文报告的被以患者为中心的疗效研究所(PCORI)采纳的方法学标准在综合分析基础上进一步凝练了各种建议,以改进以患者为中心的临床有效性比较研究的设计、实施和报告。
PCORI已制定并采纳了这一标准,为使用和报告定性研究和混合方法研究的关键部分提供了指南,在开展以患者为中心的疗效研究中,这些部分在研究计划中常常存在缺陷。
该标准可为开展健康研究人员更好地设计与实施研究提供指南,便于他们为患者和临床医生生产真实证据来分析以下问题,包括什么最有效、对谁最有效以及在什么情况下最有效。
严谨的方法学对于确保研究结果的可信度至关重要。本文描述了综合现有文献的过程,这些文献为研究者在开展健康研究中使用定性和混合方法研究提供了指导;以及开发在以患者为中心的疗效研究中应用定性和混合方法研究的方法学标准的过程。以患者为中心的疗效研究是一种临床有效性比较研究,旨在评价为满足特定健康和医疗保健需求而采用的临床或护理方法所产生的临床结果。通过关注对患者有意义的结果,以患者为中心的疗效研究可以加强证据基础,同时为患者、临床医生和其他利益相关者的健康和卫生保健决策提供信息。
以患者为中心的疗效研究中使用的方法是多种多样的,通常包括定性研究方法。广义上讲,定性研究是用于生成和分析开放式文本数据的研究方法,通过明确行为的潜在原因、观点和动机来增强对现象的理解。在定性研究中可以使用许多不同的方法,每种方法都有自己的框架和程序1。丰富的定性研究方法允许研究者根据与研究目的相关的特定需求来选择并整合研究方法。
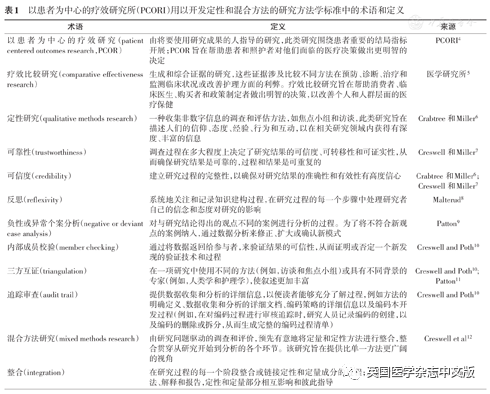
定性研究也可以用于补充和解释定量研究的结果。将定性方法和定量方法整合起来进行科学探究和评价的研究方法被称为混合方法研究2。因为研究问题驱动着研究方法的选择,因此这类研究方法是事先确定的,以利用定量和定性方法的优势来解决医疗保健服务中现存的复杂问题。这一策略是通过在研究的设计、方法、解释和报告层面上来整合定性和定量方法而实现的3。表1列出了定性方法、混合方法和以患者为中心的疗效研究的定义。本文所述的方法学标准旨在提高定性和混合方法研究的严谨性和透明度。这些标准适用于研究设计、实施和报告阶段。由于侧重于以患者为中心的疗效研究,本文不会对开展定性和混合方法研究时遇到的困难进行全面综述。
背景
以患者为中心的疗效研究所(The Patient-Centered Outcomes Research Institute,PCORI)于2010年13由美国国会成立,并于2019年14重新获得授权,通过资助严谨的疗效比较研究(以前定义为以患者为中心的医疗效果研究),以提高证据的质量和意义。这些证据可以帮助患者、护理人员、临床医生、纳税人和政策制定者做出明智的医疗保健决策,包括基于个人偏好和独特患者特征做出的最合适的预防策略、诊断方法和治疗方案等相关决策。
PCORI重视以患者为中心的相关人员参与的研究,使得研究者在疗效比较研究中越来越多地使用定性和混合方法研究。定性数据在理解人类经验中起着核心作用。与其他研究一样,这些研究产生高度完整的循证信息的潜力取决于所用的方法学和方法的质量。PCORI的授权立法尤其重视科学的严谨性,包括建立方法学委员会,制定和批准方法学指南来指导PCORI资助的研究13。方法委员会由15人组成,由美国总审计长、医疗保健研究与质量管理所和美国国立卫生研究院的主管任命。该委员会的成员是医学和公共卫生领域的专家,他们专长于研究设计,并擅长疗效比较研究或以患者为中心的疗效研究的方法学设计(https://www.pcori.org/about-us/governance/methodology-committee)。
方法学委员会于2012年开始制定了最初的一组方法学指南(同年被PCORI理事会采纳)。从那以后,委员会根据明确的方法学议题和研究相关人员的建议修订和扩大了标准。在通过定性和混合方法研究的标准之前,PCORI方法学指南由13个类别的56个独立指南组成15。前5类指南是通用的,可用于大多数以患者为中心的疗效研究,其他8类指南则适用于特定的研究目的和设计15。
偏离临床研究规范(Departures from good research practices)是导致研究质量以及后续重要性存在不足的部分原因。PCORI方法学指南为研究者提供了指导,有助于确保研究的设计和实施可以产生回答患者和临床医生问题所需的证据,如哪种方法最有效,对谁最有效,在什么情况下最有效等问题。这些指南并不是一套完整、全面的指南,可以满足所有高质量以患者为中心的疗效研究的要求,而是涵盖了有助于提高研究质量和价值的相关主题。具体而言,这些指南侧重于选出的方法学问题是在实际应用中存在缺陷或有不一致之处,包括在进行以患者为中心的疗效研究时使用不严谨或不恰当的方法。作为研究资助者,PCORI应用这套指南进行标书评审、监察受资助的研究项目,并评估研究结果的最终报告。
随着时间的推移,人们使用定性研究方法越来越普遍。2020年6月在PubMed上的检索结果显示(搜索词”qualitative methods”和”mixed methods”),1980—2019年,定性和混合方法研究的文献发表数量稳步增长。1980—1989年,检索到63篇定性方法论文和110篇混合方法论文。1990—1999年,定性和混合方法论文数量分别为420篇和58篇。2010—2019年,定性和混合方法论文的数量分别增至5 481和17 031。近年来论文的显著增长可能与PubMed中更精确的索引方法有关,也因为研究者们逐渐认识到定性和混合方法研究都是健康科学研究中的重要方法。这些方法使研究者能够获得更详细的观点,同时了解患者的动机、信念和价值观。
虽然定性和混合研究方法的使用有所增加,但对于这些方法的定义和应用仍然难以达成共识,反映出广泛的学科差异16,17。许多研究人员和组织试图通过制定指南和有助于定义研究要素的清单来解决这些差异12,16,18,19,20,21,22,23,24,25,26,27,28,29。例如,Treloar等20开发了一个包含10项条目的清单来评估临床流行病学研究中的定性研究质量,该清单可为开展定性研究的研究人员提供设计和发表研究的指导。Tong等22开发了一份包含32个条目的清单,以帮助研究人员报告访谈和焦点小组研究中的重要内容,如研究团队、研究方法、研究背景、发现、分析和解释。
PCORI定性和混合方法的方法学指南的目标是:为在疗效比较研究和以患者为中心的疗效研究中使用这些方法提供权威指导。这类研究的目的是完善临床证据基础,特别是帮助研究结果的使用者了解如何将独立研究提供的证据应用到特定的临床环境中。使用定性和混合方法可以实现这一目标,同时也引入了需要在PCORI的方法学指南中得到解决的具体问题。以前公布的指南一般聚焦更广泛且有不同的侧重点。
本文描述了汇总现有文献的过程,这些文献提供了指导研究者在健康研究中使用定性和混合方法研究的指南;同时,制定了应用于以患者为中心的疗效研究的定性和混合方法研究的方法指南。然后,我们提供一个示例,说明如何将这些指南应用在申报以患者为中心的疗效研究项目的设计中。
方法学指南开发过程
文献综述和整合
文献综述的目的是确认对健康研究中何为严谨的定性和混合方法进行方法学标准定义的期刊论文。在PCORI医学图书管理员的指导下,我们设计并检索PubMed,分4次用不同的关键词检索定性和混合方法(共8次检索,附表1见网站bmj.com)。我们的目的是确认提供方法学指南的文献,而不是简单使用了这些方法的研究。
在此过程中,我们遇到了两大挑战。首先,定性和混合方法研究涵盖广泛的内容30,31。其次,我们查询中的一些医学主题词(MeSH词表)直到最近才被引入(例如,2003年引入”qualitative methods”,2010年引入”comparative effectiveness”),这要求我们通过特定的定性方法(如访谈、焦点小组)来检索2003年之前的文献。这些挑战可能导致漏检文献。为了优化和缩小我们的检索结果,我们采用了以下纳入标准:
·用英文发表的医疗保健服务或临床研究相关文献,发表于1990年1月1日至2017年4月14日。
·文献提出或讨论了开展严谨的定性和混合方法研究的指南、标准、框架或原则。
·文献描述或讨论了定性和混合方法研究的设计、方法或结果报告。
共检索到1 933篇文献(1 070篇定性方法,863篇混合方法)。对最初的文献清单进行了审查,删除204份重复文献。3位研究者(BG、MH和AB)审阅了剩余的1 729篇文献的摘要。3位研究者基于纳入标准分别对文献的标题和摘要进行独立评估。通过面对面的会议解决意见分歧,以决定纳入哪些文献。第一轮审查筛选出212篇参考文献,并下载了这些文献全文。采用与摘要评估相同的纳入和排除标准对全文进行评估。有些文章采用定性或混合方法,但只报告了已完成研究的结果,无法提供开发定性和混合方法研究方法学标准的过程而被排除。最终纳入56篇文章(附录2,见网站bmj.com)。完成初筛后,进一步筛选文献,检索提供定性和混合方法指南的新文献,结果检索到4篇新文献纳入最终文献集。这些文献来自心理学和医学心理学专业,它们不仅提供了定性和混合方法研究的最低标准,还提供适用于广泛领域的最佳实施标准32,33,34,35。
方法学标准初始集合
使用反映定性和混合方法论文和研究方案纳入标准的摘录表,我们从文献中抽提出每条标准对应的关键主题、建议和指导。同时提取我们认为相关的其他信息。我们创建了一个综合性文档,包括所有文献的摘要和注释。这个文件概括了文献中与方法论指南有关的主题。我们首先将最宽泛的主题分为11个主要领域:理论方法、研究主题、参与者、数据收集、分析和解释、数据管理、可靠性和可信度、结果呈现、研究背景、研究者的影响(即自我反思)、混合方法。由于我们的目标是将主题凝练成与现有PCORI方法学标准不存在交叉重叠的广泛标准,因此,我们首先将主题浓缩为6个定性方法标准和3个混合方法标准。在工作组成员讨论之后,将一些标准合并,2个标准由于内容彼此重复或与先前制定的PCORI方法学标准有重复而被删除。
基于从摘录信息中确认的关键主题制定新的方法学标准初稿。然后我们作为一个团队进一步讨论主题,删除冗余,凝练主题标签,并通过基于团队的评审过程删除被认为无关的主题。将标准草案提交给PCORI方法学委员会征求反馈意见,并根据反馈进行修改。
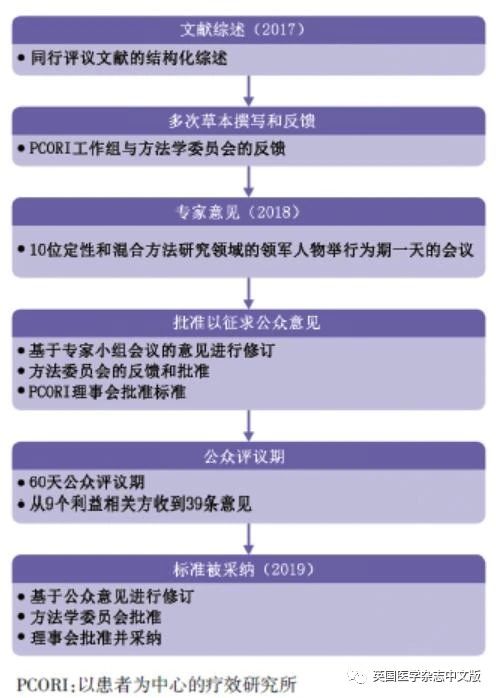
专家组一日研讨会
我们在2018年1月18日在华盛顿特区召开了为期一天的专家组研讨会。会议邀请了10位定性和混合方法领域的国际领军人物参加,包括之前制定过标准或在同行评议期刊上发表过大量采用定性和混合方法开展健康研究的专家;具有多年经验的重要研究者;以及专业教科书和期刊编辑。该小组成员的选择基于他们在方法学领域的影响力、经验以及他们在各个研究领域的代表性。专家所涉及的领域涵盖医疗保健、人类学和社会科学(附录3,见网站bmj.com)。
开会之前,我们用电子邮件向小组成员发送了一套定性和混合方法标准草案、PCORI的方法标准文件以及描述标准初稿开发方案的背景文件。在会上,专家们提供了广泛的反馈意见,包括在使用这些方法学标准时需要做好哪些工作的建议。专家组强调,在进行混合方法研究时,应根据研究问题预先选择研究方法,并强调混合方法研究的整合在研究的各个阶段(从研究开始到数据分析)都是至关重要的。专家组强调,在进行定性研究时,应在整个过程中(即抽样、数据收集和数据分析)保持灵活性和不断反思。会议发现标准草案不够全面,不足以为使用定性和混合方法开展以患者为中心的疗效研究或疗效比较研究提供指导。研讨会做出决定后,将反馈和建议整合,并于2018年春季重新撰写了标准草案(图1)。以上工作产生了一套新的标准,包括4种定性方法标准和3种混合方法标准,它们具有PCORI以前采用的方法标准中尚未包括的每种方法的独特特征。
方法学标准的持续凝练和批准
2018年春末,将修订后的方法学标准草案提交给PCORI方法学委员会。先提供标准草案文件,然后进行口头报告。方法学委员会的反馈集中在删除提交标准中的冗余内容(包括标准草案和先前采用的标准类别),并使标准更具可操作性。标准草案与现行标准重复的内容包括:研究问题的构建、以患者为中心的思想、数据完整性和分析严谨性。方法学委员会成员和工作组成员审查并评估了每项标准草案,以确认其对PCORI方法标准的独特贡献。在此之后,将剩下的每一个标准改写为初步的行动指南(而不是解释性的)。方法委员会批准了该版本的标准草案,并将其提交给PCORI理事会进行表决,由其投票批准,然后发布标准征求公众意见。
公众评议期为2018年7月24日至9月21日,评议在PCORI网站上举行(https://www.pcori.org/engagement/engageus/provide-input/past-opportunities-provide-input)。评议期间共收到39条意见,这些意见来自9个不同的利益相关者,包括7名健康研究人员、1个培训机构和1个专业组织。根据公众意见,对大部分标准草案的措辞进行了细微修改。标准的最终版本经过了方法学委员会和PCORI理事会的审查。理事会于2019年2月26日投票通过了标准的最终版本(表2)。

QM-1:阐述定性方法的应用理由、设计和实施
许多以患者为中心的疗效研究或疗效比较研究提到使用定性方法,但却未能充分描述或阐述研究要采用定性方法的理由。通常情况下,研究者在描述使用定性方法的理由时,未将其与相关文献和定性研究证据不足相关联,从而错失强调定性方法在实现研究目标同时洞察人类经验或患者心声方面重要性的机会。应简明扼要地阐述调查方法,并说明其与研究问题的关系。研究方案应明确阐述如何实施定性方法,并提供方法学选择的支持信息,如参与者招募、数据收集和分析方法。此外,还应阐述数据收集的过程,以及要收集的数据类型、何时收集数据(即,在一个时点还是纵向收集)、数据管理、编码本开发、编码员之间的可信度、数据分析以及确保机密性的程序。
QM-2:选择并解释适用的定性方法和抽样策略
通常情况下,研究者会描述焦点小组或深度访谈要招募的参与者人数,但常常不说明实际采取的抽样策略。在描述抽样策略时,应阐明其是否适用于定性方法,如何与研究问题相关,以及在研究过程中抽样策略可能发生的变化。此外,大多数研究方案中提及收集数据直到主题饱和,但未阐述如何确定主题达到饱和。因此,在标准中提出研究需要提供研究参与者相关信息,以降低得出支持不足的结论的可能性,并强调停止招募参与者和数据收集等标准的透明性。
QM-3:将定性研究的分析、解释和结论与研究问题相关联
定性分析可将数据转化为利益相关者可以使用的信息。这是一个评价、综合和解释数据的过程,以此描述和解释所研究的现象。研究过程中有许多环节需要该解释过程。它从理解在数据收集过程中听到和观察到的内容开始,然后通过数据分析建立对数据含义的理解。接下来是描述研究结果,使数据有意义。在此过程中,同时体现了研究者对研究结果的解释。许多研究者在计划书中写道:数据将被编码,但未写明由谁编码、他们的资质,以及编码过程。研究者很少描述如何得出结论以及这些结论与原始数据的关系,本标准强调研究者需要详细描述定性数据的分析和解释过程及其与整个研究的关系。
QM-4:建立定性研究的可靠性(trustworthiness)和可信度(credibility)
定性研究的设计应该包括能显示可靠性和可信度的要素。具有定性元素的研究可以使用多种方法来确保其结果的可靠性和可信度,包括追踪审查、反思、阴性或异常个案分析、三方互证或内部成员核查(定义见表1)。
MM-1:说明如何将混合方法整合到研究的设计、数据源和(或)数据采集中
本标准要求研究者事先声明并支持采用混合方法,以避免在设计和产生结果时随意改变。混合方法可以让研究者使用多种数据收集工具,而不是局限于一种方法,从而利用定量和定性研究的优势来加强研究设计。混合方法研究设计有3个关键因素:数据整合、时序和每种元素与方法间的关联。此外,在研究设计、实施和报告阶段,必须满足混合方法、定量和定性方法的标准。混合方法研究不同于多方法研究设计。在多方法研究设计中,使用两种或两种以上形式的数据(定性、定量或两者兼有)独立地解决研究问题的不同方面,而不进行整合。
MM-2:选择并阐明适用的混合方法抽样策略
混合方法研究旨在提供超出定量或定性方法本身所能提供的洞察力和知识,它们反映在抽样策略、研究设计和研究计划中。定性和定量研究可以同时进行或依次进行,研究人员必须选择和阐明最适用的混合方法抽样策略,并明确在相应时间、成本、研究团队能力和资源支持下,可以招募到的参与者数量和类型。选择混合方法所特有的抽样策略(例如,相互依赖、独立和组合)应重点考虑从研究各组成部分获得信息的深度和广度。
MM-3:整合数据分析、数据解释和结论
研究者通常对定性和定量数据分别进行分析,很少考虑何时进行这些分析,或者如何将分析、解释和结论进行整合。在定性和定量数据的分析中有多种整合方法(例如,合并、嵌套和连结)。整合方法决定了定性和定量元素的优先地位,以及分析的顺序(例如,顺序进行、同时进行、交叉迭代或其他)。无论是事先还是紧急情况下决定的,只要适用,研究人员应事先确定这些特征,确定整合点,并解释如何对这两个组成部分进行整合,以及所选的方法。
总结
在预防、诊断和治疗的多种选择之间决策对于患者、临床医生和决策者来说是一个巨大的挑战,因为他们需要做出明智的决定。以患者为中心的疗效研究侧重于对两种或两种以上的健康干预措施进行比较,以确定哪些干预在什么情景下对哪些患者和人群最有效5。使用定性和混合研究方法可以更有效地获取和理解来自患者、护理人员、临床医生和其他相关人员的信息,从而提高研究结果的强度、质量和重要性。
尽管有大量关于定性和混合方法研究的文献,这些方法在以患者为中心的疗效研究或疗效比较研究中的应用仍在继续增加,并且需要更多的指导。该指南可帮助研究者更好地设计、实施、分析和报告此类研究。例如,研究需要包括多个利益相关方的观点,了解如何在多种环境中实施干预,或记录临床背景,以便决策者能够评估研究结果是否可以转化到各自的环境中,这些需求对定性和混合方法的严谨性和灵活性提出了独特的挑战。
PCORI的定性和混合方法研究的方法学标准有助于加强以患者为中心的疗效研究或疗效比较研究的设计、实施及报告,这些标准为源自不同哲学假设、学科和程序的研究提供了广泛的方法学指导。这些标准直接影响PCORI工作人员、方法委员会成员和以患者为中心的疗效研究或疗效比较研究的评价人员来确定影响方法学完整性、准确性和清晰度的相关因素。这些标准适用于定性和混合方法研究的初学者;但是,它们不能替代适当的专业知识。
在设计和实施研究时确保研究方法的严谨并不是定性和混合方法研究所独有的挑战,因为人们普遍认识到在研究设计、实施和分析过程中增加研究价值和减少浪费的必要性36。PCORI认识到继续发展和评估方法的重要性,并致力于听取研究界的意见,根据方法学的进展和研究的需求提供最新的指导37。
BMJ 2020;371:m4435 http://dx.doi.org/10.1136/bmj.m4435
来源:英国医学杂志中文版
很多人对真实世界临床研究比较感兴趣,也在咨询,真实世界应该用什么统计学分析方法,一定要做倾向得分匹配吗?之前老套的回归分析方法不能用了吗?
不是的。
一般来说,真实世界研究与随机对照试验最大的差别之一是,真实世界研究会由于分组不均衡,存在着混杂偏倚,导致真实世界研究结果可靠性不足。
怎么办,一般情况下,最常用的方法包括传统的回归分析、网红方法倾向得分法、高大上的工具变量法等一些方法。
回归方法被称为传统方法,是因为它被发现已经快150年了!百年来如一日,手段和方法似乎就那么回事。最近几年已经被倾向得分法鄙视地一塌糊涂,毫无还手之力!
但实际上,真实世界研究也没有那么复杂的统计方法,回归分析也没有那么不堪,和倾向得分法之间,就是伯仲之间!
真实世界研究采用两种形式的回归来控制混杂:
第一种,最普通的一种,就是把混杂因素和研究的目标因素一同放入回归模型开展分析;
第二种,借助“效应改变法”来进行回归分析,控制因素!
本文借助两篇文献就来说说如何应用最普通的回归方法将文章发表在顶级JAMA和BMJ主刊上。
两篇顶级论文的基本介绍
第一篇 :BMJ: 享受艺术,延长寿命!

这篇探讨英国人艺术参与的不同频率与死亡率的关系。研究选择了2004-2005年6710名50岁及以上社区居民,随访14年后发现:与从未参与艺术活动的人相比,不断参与包括看电影在内的艺术活动的人在跟随期间的总死亡风险降低了14%,经常参与接受艺术活动的人死亡风险降低了31%。结论是人老了多参与艺术活动,看看话剧、看看电影,都是延年益寿的好事。
这是个观察性队列研究,研究因素是参与艺术的频率(从不、偶尔、经常),对照组是从不参与艺术活动的人,结局是生存时间资料。由于是观察性研究,有一堆的混杂因素。
第二篇 :JAMA: 过早自然绝经和手术绝经增加心血管疾病风险

2006-2010年间,研究组在英国招募了144260名40-69岁绝经后的女性,并随访至2016年8月。自然过早绝经指40岁前未经手术自然绝经,手术过早绝经指40岁前行双侧卵巢切除术,正常绝经的女性为对照组。在144260名绝经后女性中,与正常绝经的女性相比,自然过早绝经与手术过早绝经组中发生心血管疾病事件风险比分别为1.36和1.87,且具有统计学意义!总之,40岁前自然绝经或手术绝经增加了绝经后女性复合心血管疾病的风险。
这同样是个观察性队列研究,研究因素绝经特点(绝经时间>40岁、绝经时间<40岁但自然绝经、绝经时间<40岁但手术绝经),对照组是绝经时间>40岁的女性,结局同样是生存时间资料。这个研究显然也有一堆的混杂因素。
两篇顶级论文的基本统计分析套路
一般来说,对于观察性研究,基本思路较为简单,也就是先做一个基线差异性比较,然后挑选混杂因素开展回归分析,然后。。。。没有了!
别以为这两篇论文顶级论文会有多么高级的方法,他们也就这么干。我们不妨来看看他们的统计学方法
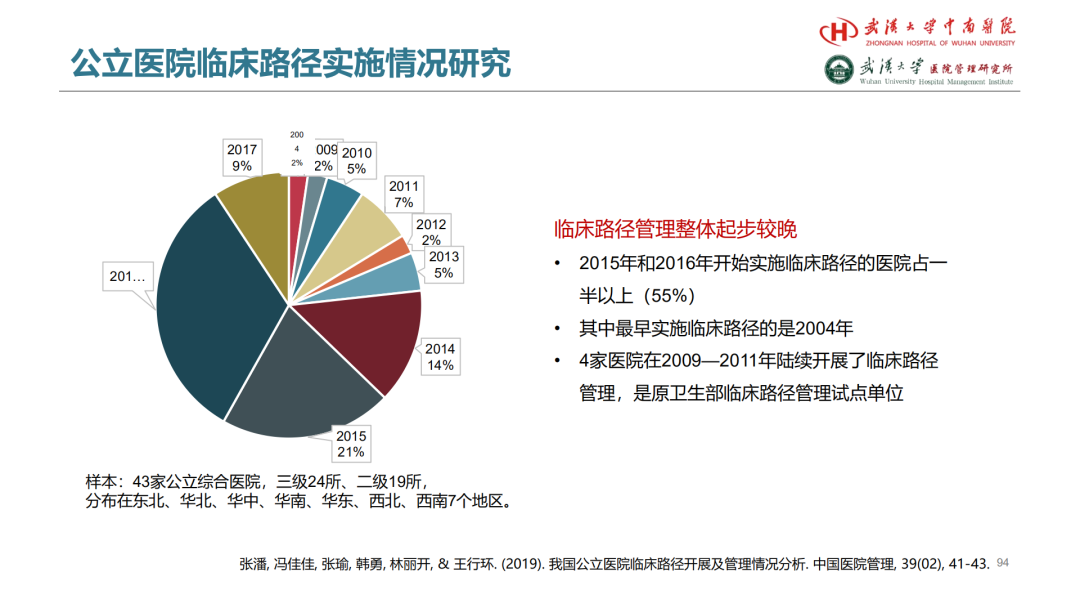
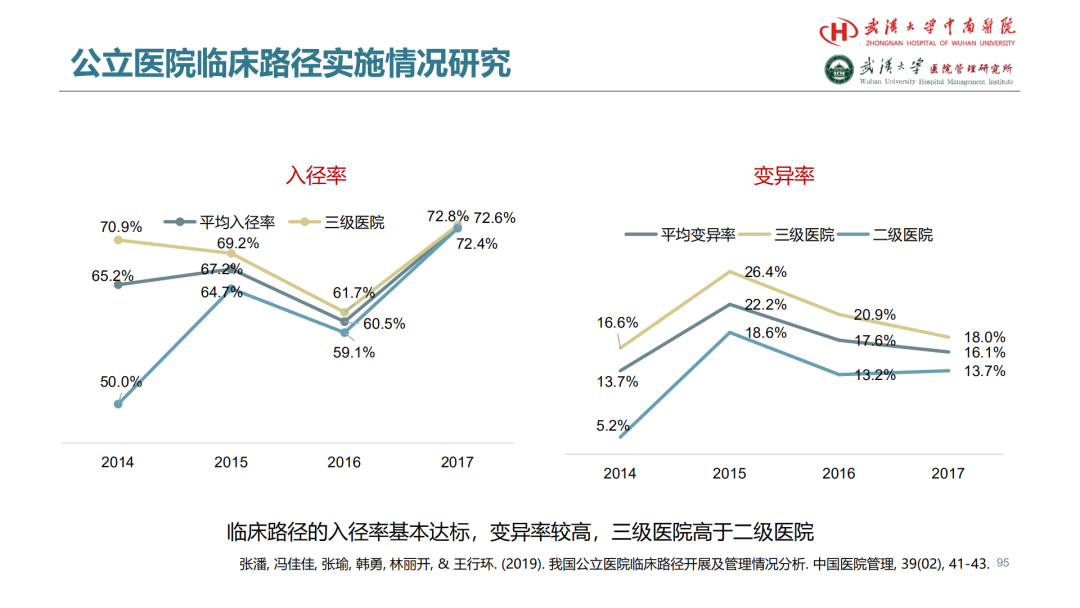
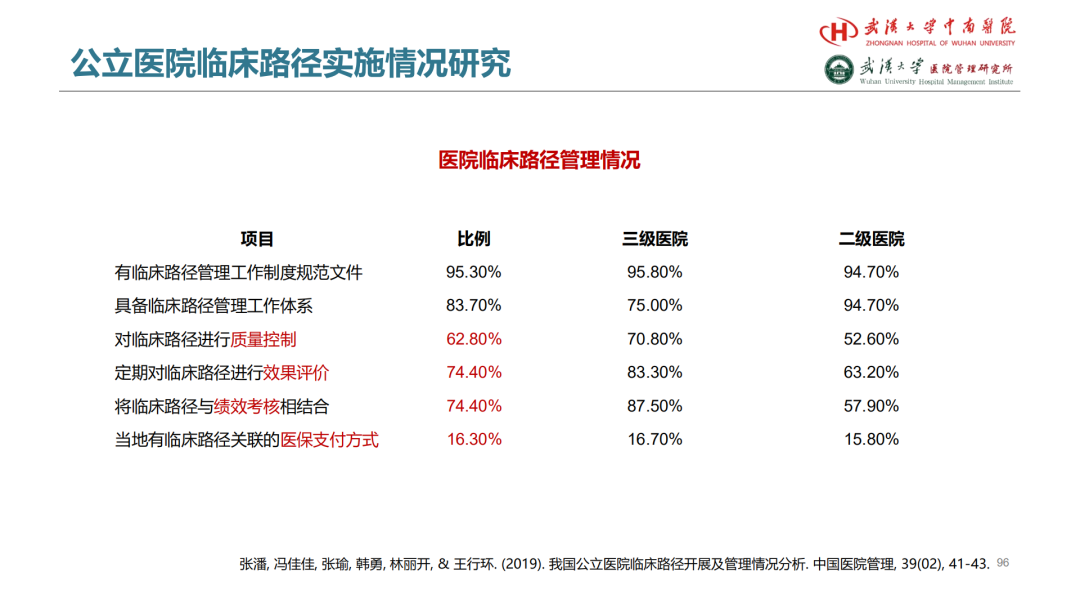
首先,进行基线差异性比较
第一篇BMJ:

第二篇JAMA:

第一篇用卡方,第二篇还考虑了定量数据的方差分析和秩和。
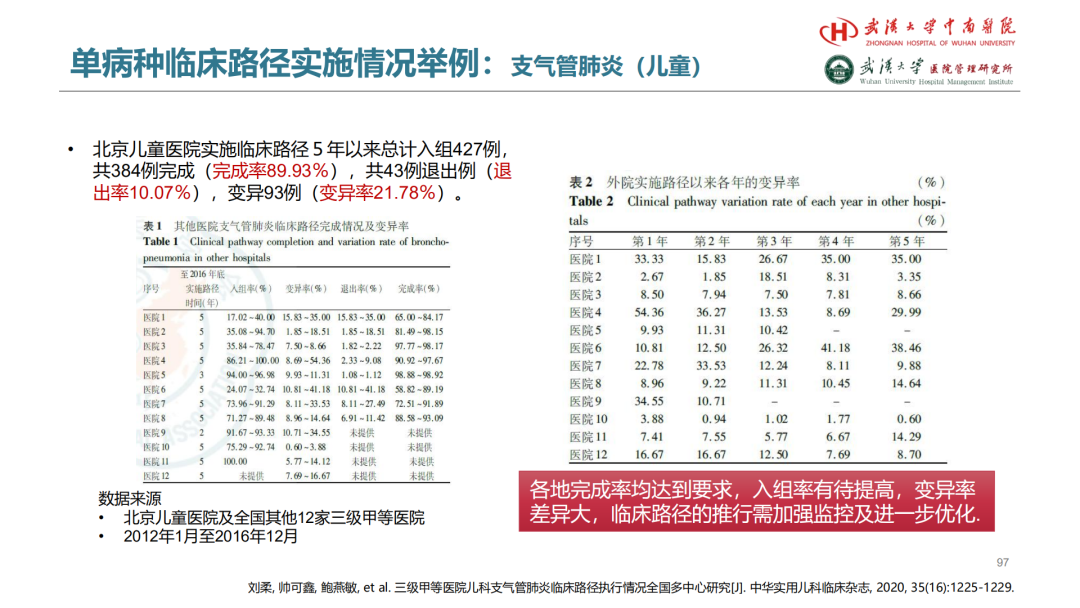
其次,上马回归分析
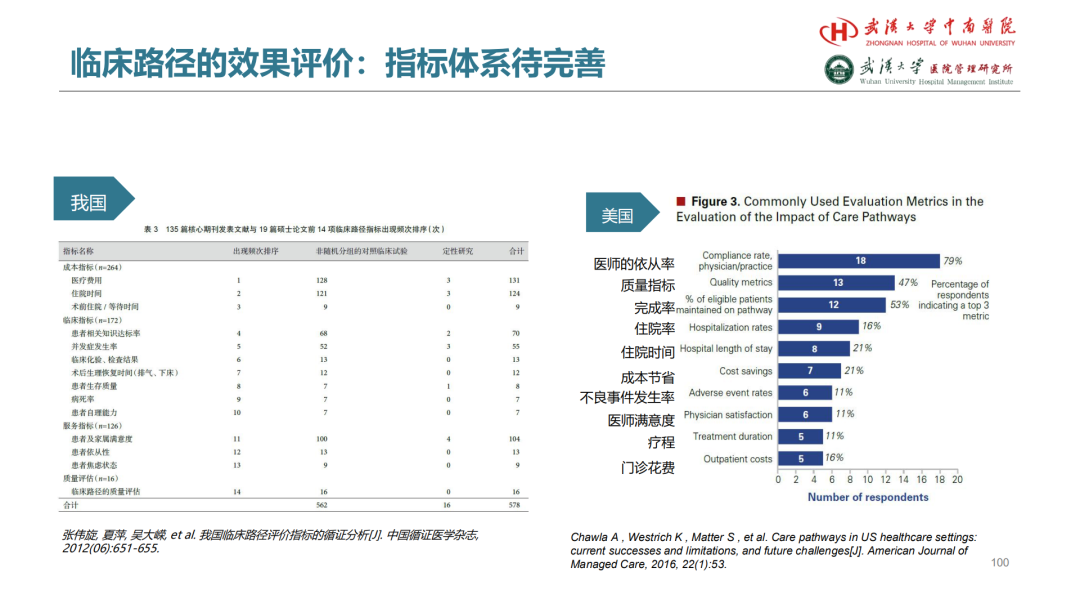
两篇论文都是生存时间资料,具有随访时间和生存结局,对于这类数据,我们一般采用K-M方法和COX回归。这碗酒,JAMA和BMJ也都干了!
第一篇BMJ:

第二篇JAMA:

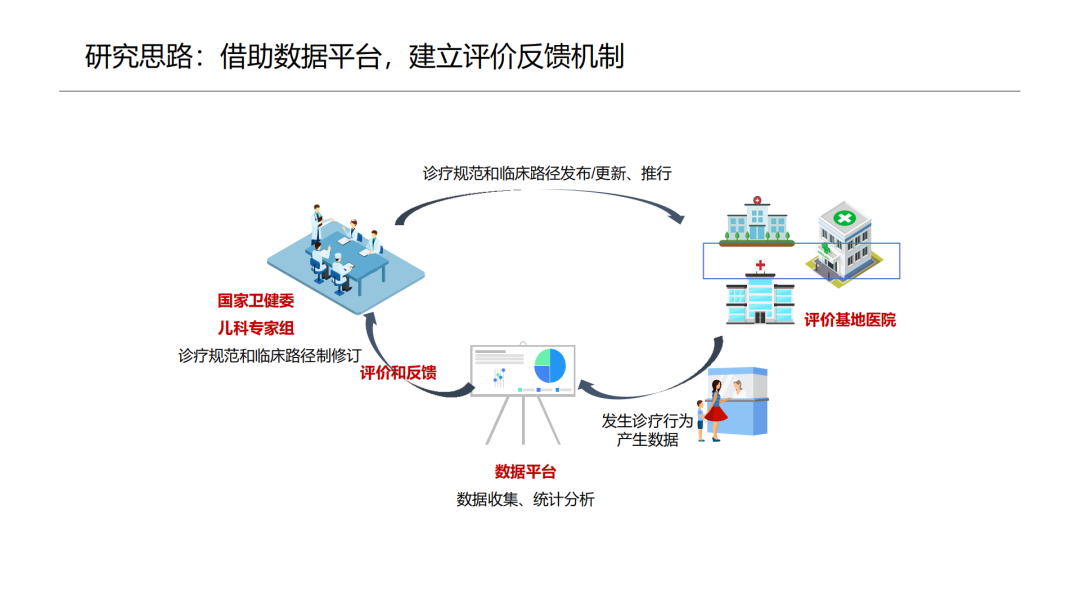
然后,列出混杂因素
任何好的任何,对与混杂因素的分析不能含糊。既然要控制混杂,必须列出哪些是潜在的混杂因素。
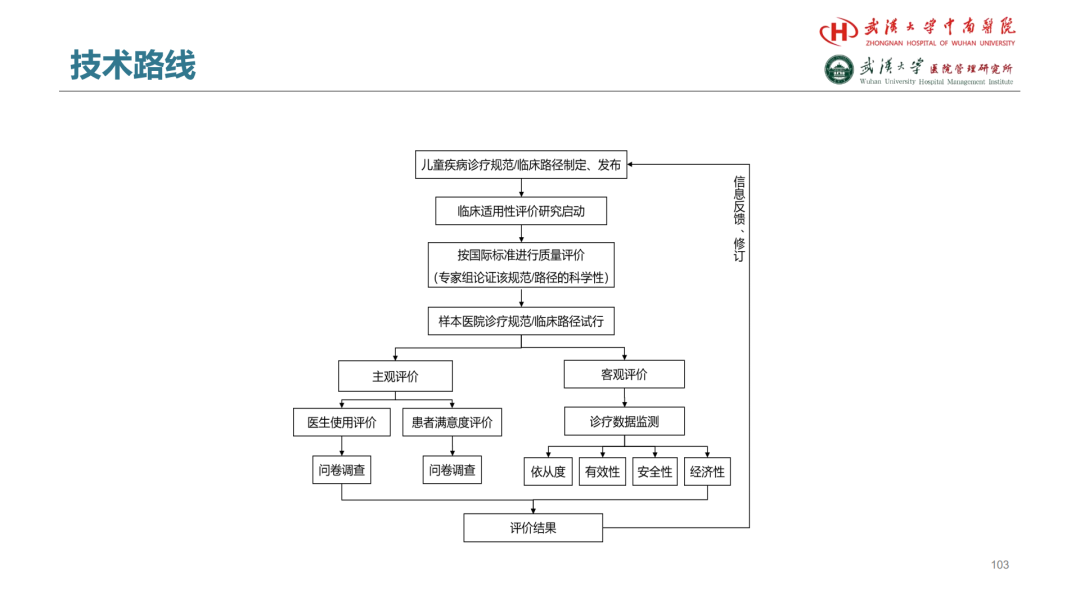
第一篇BMJ:

第二篇JAMA:


注意:COX回归都有等比例风险的假设的论证,因此,两篇论文分别都说:


其方法如出一辙,都是Schoenfeld residuals test
核心的回归分析方法就是这些。
两篇论文的主要结果
第一篇BMJ
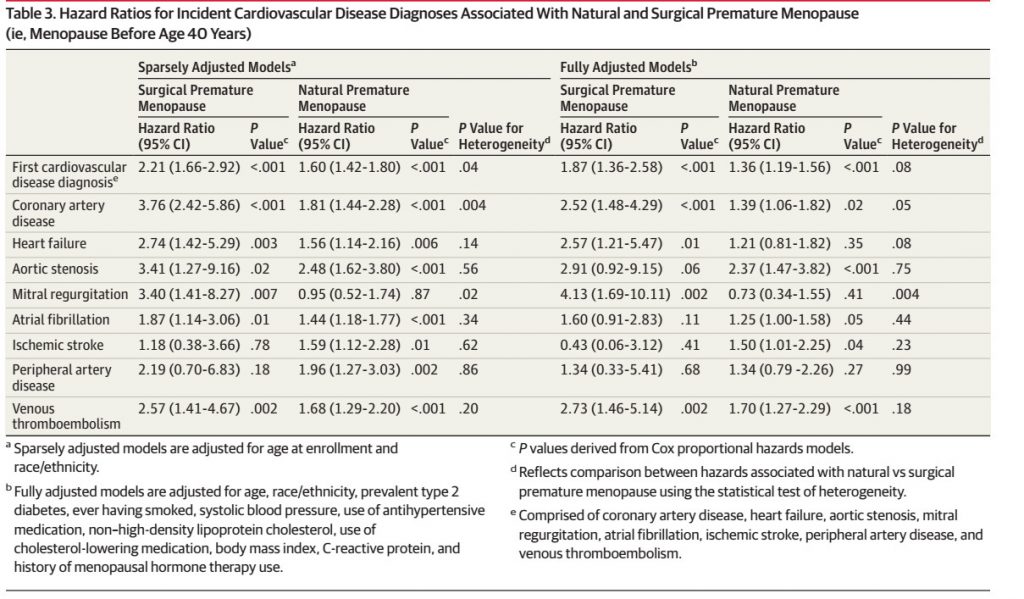
第二篇JAMA
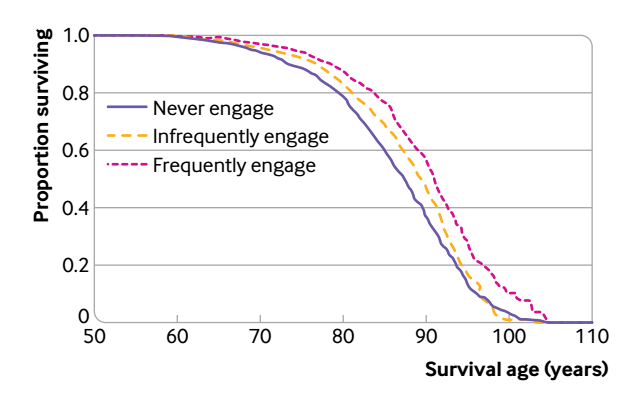
闲来郑语
当然,必须承认,作为顶级期刊发表的论文,统计学方法必然非常详细,具体还有很多小细节和考究,有兴趣的可以发送关键词到公众号对话框进行学习。
我这里想说的是,作为真实世界研究,缺失值处理和敏感性分析手段是不可或缺的!JAMA有一长段论文涉及缺失值处理,BMJ则花了足足三段文字探讨敏感性分析。
回归分析来控制混杂因素,那么如何挑选潜在混杂因素呢?一般情况下,基线存在着差异的变量可以认为是潜在混杂因素,所以观察性研究必须要结合基线差异性探讨。
此外,基线差异性的变量可能不是混杂变量,可能是中间变量!怎么办?结合有向无环图(directed acyclic graphs,DAG)是最佳的策略,比如BMJ这篇就是这么说的:

由南京中医药大学附属医院肾内科孙伟教授和法国巴黎公立医院集团比提耶-萨勒伯特医院肾内科伊莎贝拉教授联合领导的团队关于原创中成药黄葵胶囊治疗糖尿病肾脏疾病(DKD)蛋白尿的多中心、双盲双模拟、随机对照临床试验结果“Efficacy of combined abelmoschus manihot and irbesartan for reduction of albuminuria in patients with type 2 diabetes and diabetic kidney disease: A multicenter randomized double-blind parallel controlled clinical trial”近日刊登在国际糖尿病领域顶级杂志《Diabetes Care》(IF: 19.11,中科院一区)。这是近20余年来我国中医肾病学专家首次在该杂志上刊登研究成果。

研究显示,2021年全球有糖尿病患者5.37亿例,2型糖尿病患者慢性肾病的患病率为34.5-42.3%,DKD是引起终末期肾病(ESRD)的主要原因,全球约有30%~50%的ESRD是由DKD所致,不仅危害我国居民健康,也严重影响我国社会经济的发展。蛋白尿是早期肾脏病持续损害的独立危险因素,控制蛋白尿对延缓肾脏病和糖尿病肾脏病的进展有重要意义。黄葵胶囊是江苏省中医院和苏中药业集团股份有限公司共同研发的中成药产品,在治疗各类慢性肾脏病蛋白尿方面均取得明显疗效。针对中医药对蛋白尿机理的认识,研究团队瞄准了DKD蛋白尿的治疗。南京中医药大学附属医院和法国巴黎公立医院集团比提耶-萨勒伯特医院是国家中医药管理局确定的中医药国际合作单位,自2011年4月开始,两个单位共同研究、设计并联合国内8家中、西医三甲临床医疗机构开展了黄葵胶囊治疗DKD蛋白尿的多中心、双盲双模拟、随机对照的临床试验。长达十余年的国际临床科研合作的探索之旅证实黄葵胶囊与一线西药厄贝沙坦疗效相当且更具优势,两者联合用药疗效更加显著。
该研究纳入413例DKD患者,以一线推荐用药厄贝沙坦作为对照药,按1:1:1的比例随机分为黄葵胶囊组(137例)、厄贝沙坦组(138例)和联合治疗组(138例),疗程均为24周。研究结果显示:治疗24周后,黄葵胶囊组尿白蛋白/肌酐(ACR)下降了89.07±51.167mg/g、厄贝沙坦组下降了46.06±45.520mg/g、联合治疗组下降了262.31±39.081mg/g,黄葵胶囊组与厄贝沙坦组比较无统计学意义(P>0.05);联合治疗组与厄贝沙坦组比较有统计学意义(P<0.001);次要疗效指标24小时尿蛋白定量与尿蛋白/尿肌酐(PCR)治疗24周后也有明显降低。
该论文由南京中医药大学附属医院肾内科赵静医师、法国巴黎索邦大学Pitié-Salpêtrière 医院伊莎贝拉教授和南京中医药大学附属医院肾内科许陵冬主任医师担任共同第一作者,南京中医药大学附属医院肾内科孙伟教授和中国药科大学基础医学与临床药学学院顾丰教授担任共同通讯作者,南京中医药大学附属医院为该论文第一作者和通讯作者单位。该研究先后受到法国政府、中国国家中医药管理局、南京市科技局国际合作项目等支持,这是迄今为止法国政府批准的唯一中医药国际合作项目。
项目总结会
作为该研究项目重要的一环,2021年10月23日,“黄葵胶囊治疗2型糖尿病肾脏疾病临床研究”总结会在中法两国通过视频连线方式召开。会议由双主席主持,中方主席由课题负责人、江苏省中医院教授孙伟担任,法方主席由法国巴黎公立医院集团比提耶医院教授伊莎贝拉担任。

中方主席
课题负责人、江苏省中医院教授孙伟

法方主席
法国巴黎公立医院集团比提耶医院教授伊莎贝拉
法迈生医学具体承担本次项目的管理、启动、监查、答疑和关闭中心、研究者培训和实施、临床试验EDC系统的设计以及实施、数据管理等工作。中法双方课题责任单位、临床研究中心、CRO、统计单位均参与了此次会议。


合同研究组织(CRO)江苏法迈生医学科技有限公司总经理尹庆锋报告临床研究监查情况

上海中医药大学药物临床研究中心黄继汉博士报告临床研究统计结果
中方主会场邀请了国家中医药管理局科技司司长李昱,江苏省卫生健康委员会副主任、江苏省中医药管理局局长朱岷,江苏省中医药管理局中医科教处处长石志宇,泰州市卫生健康委员会副主任邵骅,泰州市姜堰区委副书记钱军等出席。法方分会场邀请法国巴黎公立医院集团国际关系部主任韦博、索邦大学医学院肾病和泌尿内科总主任博法等出席。苏中药业集团、江苏省中医院、法国巴黎公立医院集团比提耶医院三家课题责任单位及东南大学附属中大医院、南通大学附属医院、常州市中医院、苏州大学附属第一医院、泰州市中医院、无锡市人民医院、常州市第一人民医院、徐州市第一人民医院临床研究中心的领导、专家出席会议。中国驻法国使馆科技鲁荣凯参赞致电祝贺项目顺利结题。线上、线下参会人员共同见证了“黄葵胶囊治疗2型糖尿病肾脏疾病临床研究”成果。




“黄葵胶囊治疗2型糖尿病肾脏疾病临床研究”是在2007年中法两国政府签订中医药领域合作的政府协议下应运而生。本课题2011年开始先后被法方政府、国家中医药管理局批准立项(法国政府课题编号COMPL126,P13001、国家中医药管理局课题编号GZY-KJS-2019-017 )。在中法两国政府的支持和关心下,三家课题责任单位经过多次考察、互访、交流,9家中、西医三甲医院肾内科、内分泌科参与,历经十年努力,按照国际临床研究高标准、严要求,完成了临床研究,取得了令人振奋的研究成果。相信该成果将为糖尿病肾脏疾病提供一种新的治疗方案,也为黄葵胶囊的国际化奠定基础,同时该课题采取的临床研究模式将为中医药国际合作提供新的模式参考。
今天,课题组发表的研究论文登上了国际糖尿病领域顶级杂志《Diabetes Care》(IF: 19.11,中科院一区)。此次研究成果也表明,通过这样的临床研究模式让中医药物质基础说得清、作用机制说得明、应用效果说得透,可以进一步推动中医药实现中国创造、走向世界、服务全人类!

《中国中药杂志》网络首发论文
题目:基于人用经验的医疗机构中药制剂成药性评估
作者:卓静娴,丘振文,周杰,吴燕梅,杨茂林,杨忠奇
DOI:10.19540/j.cnki.cjcmm.202204012.601
收稿日期:2022-02-25
网络首发日期:2022-04-20
引用格式:卓静娴,丘振文,周杰,吴燕梅,杨茂林,杨忠奇.基于人用经验的医疗机构中药制剂成药性评估[J/OL].中国中药杂志.https://doi.org/10.19540/j.cnki.cjcmm.202204012.601
基于人用经验的医疗机构中药制剂成药性评估
卓静娴1,丘振文2,周 杰1,吴燕梅1,杨茂林1,杨忠奇2
1.广州循证医药科技有限公司,广东 广州 510060;
2.广州中医药大学 第一附属医院,广东 广州 510407
[摘要] 医疗机构中药制剂是中药新药研发重要来源,作为临床经验方的有效载体,其安全性和有效性一般都经过多年临床验证,但其向中药新药转化中还存在处方雷同、药味过多、临床定位宽泛、临床数据较少以及工艺、质量控制和知识产权问题,“三结合”中药审评体系为制剂的中药新药转化提供很好的政策支持。针对制剂中药新药转化存在的难点,提出基于人用经验的制剂新药转化路径,倡导开展制剂转化为中药新药成药性评估,提高中药新药研发成功率。制剂成药性评估首先要明确其立项选题应坚持中医临床价值观为导向,形成包括拟开发新药适用疾病、中医证型、使用人群、用法用量和疗程等人用经验资料;关注医疗机构中药制剂处方来源、演变与完善过程,评估其处方饮片剂量、药味及药材资源;明确制剂与新药的工艺路线是否基本一致,剂型选择是否合理,评估制剂工艺未来大生产的可行性;通过对制剂临床应用情况进行总结,尽可能展示其在临床应用中的全貌,有助于评估医疗机构中药制剂临床价值和开发前景;针对制剂临床安全性数据较少问题,提出结合处方开展安全性信息收集;要评估制剂临床数据质量,注重数据完整性、准确性,避免偏倚与混杂;注重知识产权保护,避免发生纠纷。
[关键词] 人用经验;医疗机构中药制剂;成药性评估
Evaluation for Druggability of Traditional Chinese Medicine Preparations in Medical Institutions Base on Human Use Experience
ZHUO Jing-xian1, QIU Zhen-wen2, ZHOU Jie1, WU Yan-mei1, YANG Mao-lin1, YANG-Zhong-qi2*
1. Guangzhou Evidence-based Medicine Tech Co., Ltd., Guangzhou 510060, China; 2. the First Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangzhou 510407, China
[Abstract] Traditional Chinese medicine (TCM) preparations in medical institutions are an important source of research and development (R&D) of new TCM. As an effective carrier of clinical experience, their safety and effectiveness have generally been clinically validated for years. However, there are still problems in preparations to transform into new TCM, such as similar prescriptions, excessive prescription ingredients, too broad clinical orientation, lack of relevant clinical data, the issue of pharmaceutical quality control, and intellectual property disputes. Nowadays, the three-combined evaluation system has strengthened policy support for the new TCM R&D. In order to improve the success rate of TCM R&D, due to the difficulties in converting TCM preparations in medical institutions into new TCM, this paper proposes the process of transforming TCM preparations in medical institutions into new TCM and advocates the evaluation for druggability of TCM preparations in medical institutions based on human use experience (HUE). The subject selection ought to be guided by the clinical values of TCM, and there should be sufficient HUE data in indication, syndrome type of TCM, target population, usage, dosage, and course of treatment. Particular attention should be paid to the source, evolution, and improvement process of prescription, and evaluate the dosage, ingredients, and herb resources of prescription. To assess the feasibility of mass production of the preparations, it is necessary to determine whether the pharmaceutical process is mostly consistent with the new drug and whether the dosage form is reasonable. By summarizing the clinical application of the preparations, showing the whole picture of its clinical application as much as possible, it is beneficial to evaluate its clinical value and R&D prospect. In consideration of the lack of clinical safety data of preparations, safety data needs to be collected according to the prescription. The quality of clinical data needs to be evaluated by focusing on the integrity and accuracy of data to reduce bias and confusion. Significant care should be paid to intellectual property protection to avoid legal disputes.
[Key words] human use experience; traditional Chinese medicine preparations in medical institutions; evaluation for druggability
临床实践是中药新药主要源泉,中药新药往往在研发前就具有临床应用基础,其中医疗机构中药制剂(以下简称制剂)一般都经过多年临床验证,较容易获得人用经验证据并向中药新药转化。与此同时我国目前制剂众多,各省市品种标准不一,各医疗机构临床应用情况差别很大。“三结合”中药审评体系提出后,如何从众多制剂中筛选出高品质制剂向中药新药转化,成为行业关注热点。本文从人用经验角度分析医疗机构中药制剂成药性,以推动更多制剂向中药新药转化。
长期以来,制剂在促进名老中医学术经验传承、推动医院特色专科发展、填充中成药市场空白、保证临床医疗需求、保障人民健康及开发新药等方面都起着积极重要的作用[1]。然而近年来各省市申报注册的中药制剂的品种、数量和适应症均呈现下降的趋势。与此同时中药新药研发也呈现明显下滑的趋势,根据国家药品监督管理局药品审评中心(Center For Drug Evaluation, CDE)发布的《中国新药注册临床试验现状年度报告(2020年)》[2],2020年正在进行的中药新药临床试验仅占全国所有在研新药临床试验的2.6%。统计2016–2021年CDE受理中药新药临床试验申请情况,6年期间仅受理194件,批准139件,其中来源于制剂转化的中药新药进入临床试验阶段的品种较少。制剂转化率低的原因较复杂,主要存在以下突出问题,具体见表1。
表1 医疗机构中药制剂新药转化存在的问题
Table 1 Problems with TCM preparations in medical institutions to transform into new TCM
序号 | 项目 | 具体问题 |
(1) | 处方组成 | 处方组成、来源、理论依据及使用背景情况不详细;重复研制,处方雷同,同类竞争品种众多,例如心脑血管领域;药味过多甚至有15~20味;日服生药量不合理。 |
(2) | 临床功效 | 临床定位宽泛,适应症众多,临床价值不清晰;制剂命名不规范,功能主治片面或者夸大描述。 |
(3) | 临床数据 | 临床数据较少,基本没有安全性数据。 |
(4) | 临床数据 | 临床数据混杂、可靠性较低、数据偏倚、夸大疗效。 |
(5) | 药材原料 | 药材基原未明确,药材资源较难持续。 |
(6) | 制剂工艺 | 剂型选择缺少依据,工艺中缺少关键工艺参数;或工艺路线不适合大生产。 |
(7) | 质量控制 | 质量控制项目过少;含量测定方法学研究资料不完善;缺少微生物限度检查方法学;稳定性试验缺少相关图谱资料等。 |
(8) | 毒理研究 | 含有法定标准中标识有毒性及现代毒理学证明有毒性的药材、“十八反”、“十九畏”配伍禁忌、药味用量超过药品标准规定等药材,毒理研究资料不完善。 |
(9) | 知识产权 | 专利保护缺失;产权归属不明。 |
2017年杨忠奇等学者提出中药人用经验理念并组织讨论,“人用经验”的理念一经提出,其科学性很快得到业界广泛的认同;2019年颁布的《中共中央国务院关于促进中医药传承创新发展的意见》[3]要求“改革完善中药注册管理,加快构建中医药理论、人用经验和临床试验相结合的中药注册审评证据体系”,这是“人用经验”首次出现在官方文件。2020年国家药品监督管理局发布的《中药注册管理专门规定》[4]提出医疗机构中药制剂人用经验对中药新药的安全性、有效性具有一定支撑作用,且经国家药审中心与申请人沟通交流认定的,可以批准开展临床试验、申请豁免药效学研究、豁免II期临床试验等,体现出国家药品监管部门对于制剂转化为新药的支持。制剂作为中医临床验方的有效载体,通过科学总结其人用经验,可成为中药新药审评证据体系的重要组成部分。
医疗机构中药制剂是中药新药研发的源头活水,其安全性和有效性一般都经过多年临床验证,从中较容易筛选出安全性高、疗效可靠的品种进行新药转化,缩短研究周期,降低研发费用。根据医疗机构中药制剂的相关法律法规及政策,归纳总结出制剂注册、备案及向中药新药转化路径,具体如图1。
图1 医疗机构中药制剂新药转化路径
Fig.1 Paths of TCM preparations in medical institutions to transform into new TCM
针对制剂新药转化存在的问题,结合中药人用经验相关技术要求,为在中药新药研发过程中合理把控医疗机构中药制剂新药转化的关键点,进一步提高中药新药研发成功率,本文提出基于人用经验的医疗机构中药制剂成药性评估要点,主要包括以下方面。
4.1立项依据
医疗机构中药制剂新药研发立项选题,应坚持中医临床价值观为导向,重视对制剂临床应用情况总结,形成包括拟开发新药适用疾病、中医证型、使用人群、用法用量和疗程等人用经验资料,作为选题立项之依据。研发的治疗领域应聚焦中医药优势病种,重视各类中医优势学科如儿科、骨科、皮肤科和耳鼻喉科等的制剂转化[5];避免选择临床定位宽泛、适应症众多,临床价值不清晰、功能主治片面或者夸大描述的品种。避免出现与已上市药品组方类同、功能主治基本一致的情况,若存在类似的已上市药品,需分析是否有疗效优势或治疗的特点,否则不合适继续开发。
4.2制剂处方评估
应关注制剂处方来源、演变与完善过程,评估其处方是否有清晰、完整的从产生、使用、发展、变化的完整历程[6]。重点关注其处方的来源出处,梳理演变的过程,适应的病证在演变的过程中是否有所改变。对制剂的处方饮片剂量、药味数量进行合理性分析,评估是否有合理的日服生药量和药味数量以保证安全性和临床治疗需求。评估处方中组方是否合理,是否有符合中医学理论的方解,并按方解中的“君、臣、佐、使”对处方的药物进行排列,书写科学规范的炮制品名称,主治为君,兼治为臣,八纲为佐,引经为使,体现出处方的统一性、完整性和有序性[7]。同时关注处方是否有贵细、有毒药材,初步评估处方中的药材资源。处方如果存在“十八反”、 “十九畏”等配伍禁忌,含有毒药材或现代研究公认有毒性的药味的制剂,处方饮片剂量明显超过药典规定,或处方中包含没有标准的饮片,一般不合适开展基于人用经验的医疗机构制剂新药转化。
4.3制剂工艺评估
国家药品监督管理局支持以制剂为基础研制中药新药,指出中药新药工艺路线与既往医疗机构中药制剂基本一致的,或能够说明制备工艺差异不会引起药用物质基础或药物吸收、利用发生明显改变,合理使用人用经验证据,可申请豁免工艺、稳定性研究和豁免Ⅰ、Ⅱ期临床试验,因此保持制剂工艺稳定性十分重要。在对制剂是否适合转化为中药新药时,应全面、科学、客观、可量化的对制剂进行整体质量评价,并重视生产工艺的是否持续改进并固定[8]。
剂型合理性方面主要考虑不同剂型的工艺关注点,如口服固体制剂的引湿性、熔化性;口服液体制剂的澄明度;要考虑提取物的性质与剂型的匹配度;另外还需关注患者用药的依从性(剂型、口感)。不同的剂型存在不同的缺点,应权衡利弊:①传统的中药液体制剂(合剂)存在服用量大,长时间放置或保存不当容易发生霉变,携带不方便等缺点;②胶囊剂,散剂、丸剂大都由中药饮片粉碎成细粉直接制备,存在微生物控制难、载药量小、装量差异大吸湿性大等问题;③中药颗粒剂是由中药汤剂演变而来,最接近中药传统剂型,且具有稳定性高、口感佳、便于携带服用方便等优点,是医疗机构制剂的较优选择,但也存在着临床试验时安慰剂较难制作,破盲风险较高的问题。
作为新药研发应关注按照制剂工艺未来大生产的可行性,包括评估生产批量、工艺流程的合理性、工艺复杂程度和生产成本等。建立制剂工艺整体质量评价体系,充分考虑大生产存在的各类问题,做好风险评估工作,满足大生产质量均一、稳定可控的需求。参考《中药新药质量标准研究技术指导原则(试行)》[9],对医院机构中药制剂质量标准进行评估,包括:①处方所有药材的鉴别,包括药材资源、标准、基原、产地、采收期等因素;②建立反映制剂特点的检查项目,如提取天然单一成份的口服固体制剂应建立有关物质、溶出度等检查方法;含难溶性提取物的口服固体制剂,应进行溶出度的检查研究;制剂含毒性成分,应建立质量控制方法;③多成份含量测定方法、限度和范围,及其含量测定指标。同时,应关注源头的质量控制,量质传递,包括药材或饮片、中间体及辅料;质量标准应能反映制剂质量,与药品安全性、有效性相关联;基于“整体观”评价中药制剂的质量,保持批间质量的稳定可控。
4.4 制剂临床有效性和安全性评估
医疗机构中药制剂具备积累临床数据的天然优势,这是制剂向中药新药转化的显著优势,对于制剂临床数据评估,是对医疗机构中药制剂成药性评估之重点。
中药传统复方制剂注册或备案成为医疗机构中药制剂前,处方通常在临床应用5年以上,至少100例临床应用基础,或已开展不少于60例临床研究[10]。作为医疗机构中药制剂注册或备案后,应该积累大量临床应用案例。成药性评估中应对制剂既往临床应用情况进行总结,包括使用排名前列的科室、主要适应症及中医证候、使用人群及其分布、各主要使用人群的病例数、用法用量、疗程、年度销量等数据,并可以通过访谈、临床经验、病案资料收集等方法,对用药经验与规律、独特疗法、典型病案、合并治疗情况等方面进行评估,尽可能展示其在临床应用中的全貌。通过对临床应用情况总结,有助于评估制剂临床价值和开发前景。
作为医疗机构中药制剂,一般来说具有较好的临床疗效,但是对其临床有效性开展评估仍然十分重要。因为作为中药新药研发之产品,其临床疗效要与已有上市品种比较和/或目前最佳治疗药物疗效进行比较,具有优效性或非劣性,所以要对制剂的临床疗效全面评估并作出预判。制剂有效性数据来源多样复杂,开展较规范的临床研究很少,大多数来源于门诊或住院病历信息系统、慢性疾病随访系统,或是简单临床应用观察总结,这些真实世界数据可以初步评估医疗机构中药制剂的有效性[6]。
囿于医疗机构中药制剂在临床中的使用场景,患者用药后的随访不足且临床医师对制剂安全性关注度较低,不良事件、不良反应及实验室检查异常值等临床安全性数据往往不完整,导致安全性风险可能被低估[11]。应结合处方组成评估制剂安全性,通过门诊或住院病历信息系统分析可能的安全性信息,作为其临床安全性有益补充。
4.5 制剂临床数据质量评估
数据可靠性是医疗机构中药制剂成药性评估的基础,所以要对制剂临床数据进行评估,如临床诊断的病名及中医证型是否一致,制剂用法、用量与疗程,是否存在影响结果评价的合并用药等。注重数据完整性、准确性、数据质量保证与质量控制方面所采用的措施,并考虑是否有潜在的偏倚与混杂因素,进一步得出稳健的因果推断。
如果医疗机构中药制剂已经开展临床研究,应评价其诊断标准、纳入标准、排除标准是否科学、一致,是否采用同行认可的疗效评价指标,是否符合目标适应症或临床定位,收集到的疗效评价数据是否完整、真实、可溯源,符合上述要求的合格病例数是否足够,合并用药与合并治疗是否合理控制等。
4.6 知识产权与商业合作
医疗机构中药制剂的持续、健康发展和知识产权及商业价值密切相关,尤其是在评估其中药新药成药性时,清晰的知识产权、合理的商业价值是品种持有机构及意向企业达成合作的基础。由于制剂处方保密性,为了保护其技术、经济价值,所属医疗机构的专利申请主观意愿较低,从而造成知识产权保护的恶性循环[12]。开展制剂成药性评估时应适当评价其专利保护情况,是否采用专利申报、商业秘密保护等手段保障其知识产权,评估其知识产权保护手段的有效期、受益及保护主体。
医疗机构中药制剂多为名老中医及其师承团队多年临床经验的结晶,持有主体则为所属医疗机构,若涉及成果转让,常遭遇产权归属不清晰、受益分配不明确的情况,实际操作中常出现转让资质不足、暂无转让意图、不清楚转让流程等情况,导致难以持续推动该制剂的新药转化。建议医疗机构主动理清制剂的产权归属,并对转让意愿等基本信息进行梳理。可委托行业组织等研发平台,研究拟采取的合作研发方式与惠益分享途径,合理评估其商业价值。
虽然近年来医疗机构中药制剂新药转化较少,但是随着国家药品监管部门重视人用经验对制剂新药转化的支持,制剂新药转化迎来了难得的机遇。医疗机构作为品种持有主体,可主动对本机构现有的中药制剂进行全面、深入的梳理,汇总各品种的既往使用情况,就功能主治、处方来源、组方理论依据等关键信息进行分析,逐步建立并实施知识产权保护方法,梳理各品种产权归属及转让意愿。基于对拟开发的品种与医疗机构中药制剂工艺路线基本一致时,才能充分利用人用经验证据以申请豁免部分研究;因此医疗机构制剂室在工艺研究及质量控制方面宜提前布局,持续改进并固定重点品种的关键工艺参数,适时评估其药材资源、工艺放大条件、质量控制标准等大生产可行性,必要时还可开展毒理试验等非临床安全性评价,作为医疗机构中药制剂新药转化的有益补充。医院应鼓励名老中医及其师承团队参照人用经验相关研究方法,在临床实践中持续观察并总结医疗机构中药制剂的临床价值,发掘其准确的临床定位,采用实效性临床试验、登记式研究等更为贴近临床实践的研究方法,对各品种的使用最佳剂量、最佳人群、有效性观察指标、安全性数据进行观察,积累高质量人用经验数据,加速医疗机构中药制剂向中药新药的转化。中药研发企业可通过早期介入、联合研发、惠益共享等方式,及早、主动与医疗机构合作,筛选、储备具备研发基础的优秀制剂品种。参考医疗机构中药制剂成药性评估要点,充分利用“三结合”中药新药注册审评体系,促进更多优质医疗机构中药制剂转化为中药新药。
[参考文献]
[1] 王克金,辛妤.医院制剂产业的现状、存在的问题及发展方向[J]. 中国卫生产业,2017,14(01):4-6.
[2] 国家药品监督管理局药品审评中心.中国新药注册临床试验现状年度报告(2020年) [EB/OL]. (2021-11-10) [2022-02-22]. https://www.cde.org.cn/main/news/viewInfoCommon/d670723dd2f646722097b03cf005e052
[3] 中共中央国务院关于促进中医药传承创新发展的意见[N]. 人民日报,2019-10-27(001).
[4] 国家药品监督管理局.中药注册管理专门规定(征求意见稿) [EB/OL]. (2020-04-30) [2022-02-22]. https://www.nmpa.gov.cn/zhuanti/ypzhcglbf/ypzhcglbfzhqyj/20200430154501315.html
[5] 蒋宁,杜保民,杜冠华,等. 新思路·新技术——中药复方新药研发相关重大科学和技术问题[J]. 中国药理学与毒理学杂志,2020,34(04):241-260.
[6] 杨忠奇,汤慧敏,唐雅琴,杜彦萍,高蕊,胡思源,元唯安,邹冲,丁红,赵艳玲. 试论真实世界研究与人用经验在中药新药研发中的应用[J]. 中国中药杂志,2021,46(22):5987-5991.
[7] 李园白,崔蒙,杨阳,等.方剂剂量与君臣佐使关系初探[J].中草药,2015,46(13):2011-2014.
[8] 国家药品监督管理局.中药复方制剂生产工艺研究技术指导原则(试行) [EB/OL]. (2020-12-04) [2022-02-22]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20201204153840138.html
[9] 国家药品监督管理局.中药新药用药材质量控制研究技术指导原则(试行) [EB/OL]. (2020-10-10) [2022-02-22]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20201016144518188.html
[10] 国家食品药品监督管理局. 医疗机构制剂注册管理办法(试行) [EB/OL]. (2005-6-22) [2022-02-22]. http://www.gov.cn/gongbao/content/2006/content_292146.htm
[11] 杨忠奇,唐雅琴,汤慧敏,等.试论中药人用经验资料收集、数据质量与证据形成[J].中国中药杂志,2021,46(07):1681-1685.
[12] 钱珍光,王艳翚,朱艳娇.专利和商业秘密在医疗机构中药制剂保护中的作用[J].医学与社会,2019,32(07):122-125.
[基金项目] 广东省药品监督管理局项目{2021}[0357]号
[通信作者] 杨忠奇,教授,主任医师,博士生导师,主要从事中医药临床/中医心血管内科研究,E-mail: [email protected]
[作者简介] 卓静娴,初级工程师,研究方向为中药临床试验,E-mail:[email protected]
来源:《中国中药杂志》
血塞通软胶囊综合评价研究
来源
中国临床药理学杂志
第37卷第12期2021年6月(总第338期)
作者
董子洵①,韩晟②,林丽开①,史录文②
(①武汉大学医院管理研究所,湖北武汉430071;②北京大学 医药管理国际研究中心,北京100191)
摘 要
目的:以临床常用血塞通软胶囊为例,探索中成药综合评价的内容和方法,为中成药的临床合理使用、中成药价值的研究开发以及药品相关决策提供依据,推动安全有效合理用药。
方法:基于系统检索文献和药品生产企业提供的研究资料,利用循证医学和药物经济学等基本方法,从药学特性、有效性、安全性、经济性、适宜性、可及性和创新性等方面对血塞通软胶囊进行评价。
结果:血塞通软胶囊有效成分和在说明书适应证上的药理作用明确,临床疗效肯定,安全性良好,服用依从性好,药品质量有保障。
结论:通过不同的系统检索文献,结果与已经获多个中西医临床诊疗规范和推荐指南中的指标相一致。总之血塞通软胶囊的临床前与临床使用的证据已形成一定的体系,但同时,在不同临床应用中的药理机制挖掘、临床扩展应用中的有效性和安全性、个体精准用药尚需要更深入进行不同研究。
关键词:口服制剂;药品综合评价;血塞通软胶囊
中成药药品市场的规范发展在国家经济和社会发展中起着重要的作用,世界也正在以开放的态度接受传统 医 药。血塞通软胶囊是以我国珍贵中药材——云南道地药材三七为原材料制成的中成药,临床上广泛应用于心脑血管疾病的防治。本文对血塞通软胶囊(每粒含三七总皂苷60mg)的药学特征和临床应用作综合评价,为临床合理用药、规范临床决策和促进中成药的研发等提供科学的参考依据。
资料与方法
1 资料来源与文献检索方法
1.1 检索方法
以中国知网、万方数据库为主要数据库,检索式为“主题=血塞通”;英文文献对 Web of Science平台数据库(含 Medline数据库)、EmBase数据库,全文包括Elsevier、Wiley等主要数据库,检索式为 “title=xuesaitong”。另外,以血塞通软胶囊的主要成分“三七总皂苷”“panax notoginseng saponins”“notoginseng total saponins”为关键词进行补充检索。时间范围截至2020年10月。文献类型限定为综述(reviews)、论文(article);不包含通信(letter)与会议信息。
1.2 检索结果分析
根据中文文献检索的数据以及数据库情况,将两个数据库的中文文献进行整合、汇总,删除重复的、不相关的文献,最终得到5108篇血塞通相关文献。将Elsevier Scopus、EmBase数据库、Web of Science平台数据库(含Medline数据库)和Wiley这4个数据库的英文文献进行整合、汇总,删除重复文献,最终得到192篇血塞通软胶囊相关文献。将所有入选文献根据药学特性、有效性、安全性、经济性、质量、顺应性进行分类,建立相应的数据集。
2 药品综合评价的内容
本研究的综合评价内容包括 7个部分:药学特性评价、有效性评价、安全性评价、经济性评价、适宜性评价、创新性评价和可及性评价。通过分部评价最终得到综合结果与建议。
本指标是参考国家卫生健康委发布的《药品临床综合评价管理指南(试行)》[1]并结合已发表的研究进行评估,各部分采用相应循证医学方法进行评价。
3 血塞通软胶囊的药理与药学特性评价
3.1 有效成分[2]
血塞通软胶囊的主要成分为三七总皂苷(PNS),是三七的主根或根茎经加工制成。6种常见的皂苷类成分,除药品标准中的人参皂苷Rb1、Rg1和三七皂苷R1外,还有人参皂苷Rc、Rd和Rh1。
3.2 中医基础理论中的中药功能
三七的功效在历代本草中有相似的记载,有活血、止血和补血的作用[2]。《本草纲目》中记载,三七“近时始出南人军中,用为金疮要药,云有奇功”,又云“止血散血定痛,金刃箭伤、跌扑杖疮、血出不止者,嚼烂涂,或为末掺之,其血即止"。《本草求真》记载:“世人仅知功能止血住痛。殊不知痛因血瘀则痛作,血因敷散而血止。三七气味苦温,能于血分化其血瘀。”《本草纲目拾遗》记载:“人参补气第一,三七补血第一”。
根据《中国药典》(2020年版)记载,三七甘、微苦,温,归肝、胃经,功能为散瘀止血、消肿止痛。
3.3 药物作用及其机制
血塞通软胶囊具有多重药理作用,机制复杂,涉及多个靶点、信号通路和代谢途径,且不同皂苷成分也发挥着不同的药理作用,机制不尽相同。
3.3.1 药理学和组学研究对药物作用机制的分析
在冠心病治疗的机制研究中,药理学预测和分析发现,PNS的潜在靶基因有679个,有血管内皮生长因子A(VEGFA)、基质金属蛋白酶(MMP)9、MMP1和cAMP反应元件结合蛋白1(CREB1)等14个参与冠心病治疗的相关信号通路靶基因,涉及Relaxin、磷脂酰肌醇 3激酶(PI3K)/丝苏氨酸蛋白激酶(Akt)、肿瘤坏死因子(TNF)和雌激素信号通路,以及流体剪切应力和动脉粥样硬化等,提示 PNS通过靶向调控14个冠心病潜在靶基因,发挥抗炎、抗动脉粥样硬化、抑制内皮细胞凋亡和保护缺血心肌等作用[3]。另一项研究通过基因相互作用网络和功能富集分析发现,11个基因可能是PNS治疗冠心病的直接靶点,并在细胞因子 -细胞因子受体相互作用通路中富集,同时可以影响其他 85个基因,涉及另外7个信号通路,提示PNS治疗冠心病可能与免疫调节、抗凝、降血脂和抗血小板等机制有关[4]。
在缺血性脑血管病治疗的机制研究中,通过转录组分析,比较大鼠大脑中动脉闭塞模型组与空白组、模型组与血塞通软胶囊干预组的差异 表达基因(DEGs),模型组与空白组共鉴定出870个DEGs,模型组与血塞通软胶囊干预组共鉴定出1189个DEGs,其中重叠DEGs提示:ANTXR2、FHL3、PRCP、TYROBP、TAF9B、FGFR2、BCL11B、RB1CC1和MBNL2可能是血塞通软胶囊治疗大脑中动脉闭塞机制的关键基因和作用位点[5]。
3.3.2 血液系统调节作用
血塞通软胶囊的活血祛瘀作用可能表现在抑制血小板聚集、抗凝血、降低全血黏度、扩张血管管径、增加血液流速和改善微循环等方面。研究显示,血塞通软胶囊可显著抑制正常大鼠及血瘀大鼠血小板聚集,延长活化部分凝血活酶时间和凝血酶时间,降低纤维蛋白原水平[6]。在家兔眼球微循环障碍模型或小鼠耳廓局部微循环障碍模型中,血塞通软胶囊可扩张血管管径,增加血液流速和毛细血管网的数量[7]。血塞通软胶囊可以明显降低大鼠的全血黏度,减少全血高切、中切和低切的黏度值,显著减少红细胞电泳的时间[8]。
研究显示,三七制剂可降低血小板聚集率和血小板花生四烯酸代谢产物血浆血栓素 B2(TXB2)的水平[9]。PNS可调节血管内皮细胞环氧合酶(COX)-2的表达,升高6-酮-前列腺素F1α的水平,并下调COX-1的表达,降低TXB2的水平,PNS发挥抑制血小板黏附和聚集的作用,可能与抑制细胞内钙动员和ERK2/p38活化有关[10]。血塞通软胶囊治疗高黏血症患者后,患者的血小板聚集率、血小板黏附、内皮素、前列环素和血栓素与治疗前相比有显著差异(均P<0.05),提示其抑制血小板活化的途径可能是多组分通过多环节实现的[11]。
3.3.3 抗炎和免疫调节作用
研究显示,PNS能够降低M1型巨噬细胞一氧化氮、白细胞介素-6(IL-6)以及高速泳动族蛋白B1(HMGB1)的分泌量,也可抑制炎症因子IL-1β、TNF-α和核因子 κB(NF-κB)等的表达,促进抗炎细胞因子IL-10的表达[12]。
三七皂苷R1可通过激活过氧化物酶体增殖物激活受体(PPARγ)抑制氧化低密度脂蛋白诱导的炎症因子TNF-α和IL-1β的表达,进而抑制NF-κB和促分裂原活化的蛋白激酶(MAPK)活化[13]。在动脉粥样硬化易感小鼠模型中,三七皂苷R1可抑制单核细胞炎症反应,减轻心肌炎症[14]。三七皂苷R1可改善内毒素血症小鼠内皮型一氧化氮合酶(eNOS)和诱导型一氧化氮合酶(iNOS)之间的失衡,抑制NF-κB的活化,减轻心肌炎症和细胞凋亡,其作用与雌激素受体ERα和PI3K/PKB(Akt)信号的激活密切相关[15]。
对血脂异常和慢性炎症诱导的动脉硬化动物模型中,血塞通软胶囊可降低血清总胆固醇、三酰甘油和低密度脂蛋白胆固醇等血脂水平,降低动脉粥样斑块中脂质含量,以及降低IL-6、IL-1β、TNF-α和C反应蛋白水平,减轻炎症反应,延缓动脉粥样硬化的进展[16]。此外,PNS对机体免疫功能的调节作用是多方面、多靶点的,对免疫器官、T细胞及其亚群、NF-κB、细胞黏附分子和细胞因子等免疫分子都具有一定的调节作用[17]。
3.3.4 抗氧化应激
PNS可减轻D-半乳糖诱导亚急性衰老大鼠模型的氧化损伤,降低衰老状态下大鼠肝细胞线粒体DNA相对含量及血清丙二醛(MDA)含量,提高血清超氧化物歧化酶(SOD)活性;同时还能够增加衰老状态下大鼠血清IL-2含量,降低IL-6含量[18]。PNS可通过PI3K/Akt通路激活Nrf2抗氧化信号,抑制NF-κB炎症信号传导,减轻脂多糖诱导的血脑屏障损伤和脑血管内皮细胞的单核细胞黏附。在大鼠失血性休克模型中,PNS能提高SOD活性,降低MDA、内毒素和髓过氧化物酶水平,降低TNF-α和IL-6的表达,降低肺组织和肠组织含水量。PNS对氧化应激损伤引起的细胞弹性模量降低有明显的抑制作用,结合免疫荧光分析,表明提高细胞骨架的稳定性可能是PNS在细 胞氧化损伤中发挥保护作用的重要途径[19]。
3.3.5 调节细胞凋亡
研究表明,在正常衰老大鼠中,PNS可显著改善衰老的心肌形态学改变,减轻心肌细胞凋亡,改善线粒体功能障碍,逆转FoxO3a和锰超氧化物歧化酶(Mn-SOD)的下调及PGC-1α、LC3β和Beclin-1的上调,提示 PNS能够通过氧化应激和线粒体功能相关的信号途径减轻氧化损伤而发挥抗凋亡作用[20]。PNS可降低三酰甘油诱导的细胞质钙、线粒体钙和内质网钙的升高,浓度依赖性地保护心肌细胞免受三酰甘油诱导的内质网应激反应和相关细胞凋亡的影响。一种微小RNA(miR-30c-5p)的过表达可增加缺血再灌注损伤心肌细胞的存活率,减少心肌细胞的凋亡,给予PNS处理后,缺血再灌注损伤心肌细胞中miR-30c-5p表达水平显著升高,P53蛋白表达水平降低[21]。另外,激活PI3K/Akt信号通路可能是PNS抵抗缺血诱导的心肌细胞凋亡的途径之一。在糖尿病大鼠中,PNS可通过调节PTEN-PDKI-Akt-mTOR信号通路,减轻足细胞凋亡、足细胞形态学改变、蛋白尿及系膜扩张[22]。另一方面,PNS也可通过上调促凋亡蛋白 P53、Bax、caspase-3表达和下调抗凋亡蛋白Bcl-2表达,抑制血管平滑肌细胞的异常增殖,诱导血管平滑肌细胞凋亡[23]。血管平滑肌细胞的异常增殖在动脉粥样硬化的形成中起着重要作用,这可能是 PNS抗动脉粥样硬化作用的药理学基础之一。
3.4 药学研究
在pH6.8磷酸盐缓冲液和水两种介质中(《中国药典》2010年版附录XC:转篮法和桨法),45min溶出度均为80%左右,且同一批次的血塞通软胶囊溶出度差异较小;以三七皂苷R1为参比,血塞通软胶囊中人参皂苷Rg1和Rb1的溶出曲线相似性因子(f2)均大于50,具有相似的溶出特点[24]。
药物的剂型不同会影响有效成分的溶出、吸收及临床疗效。研究显示,血塞通软胶囊5种皂苷成分间f2均大于50,5种皂苷的溶出行为比较差异无统计学意义(P>0.05),呈现出同步性。用溶出度测定法小杯法(《中国药典》2020年版二部附录XC:溶出度测定第三法)测定血塞通软胶囊(每粒含三七总皂苷60mg)的溶出曲线,结果显示血塞通软胶囊剂型以油相为内容物基质具有一定的缓释作用,溶出曲线较平缓,可提高PNS在胃肠道的滞留时间。
3.5 药代动力学
3.5.1 在消化液中的稳定性
为研究血塞通不同剂型在胃肠中首过效应的差异,将血塞通不同剂型内容物分别在胃液或肠液中共同孵育,比较不同剂型中血塞通有效成分的稳定性差异[25]。
3.5.2 体内药代动力学
大鼠分别单次口服血塞通软胶囊 (PNS 31.25mg•kg-1)、血塞通软胶囊(PNS 31.25mg•kg-1)联合阿司匹林(20.83mg•kg-1)后,各种皂苷成分的药代动力学参数[26],结果见表 1。
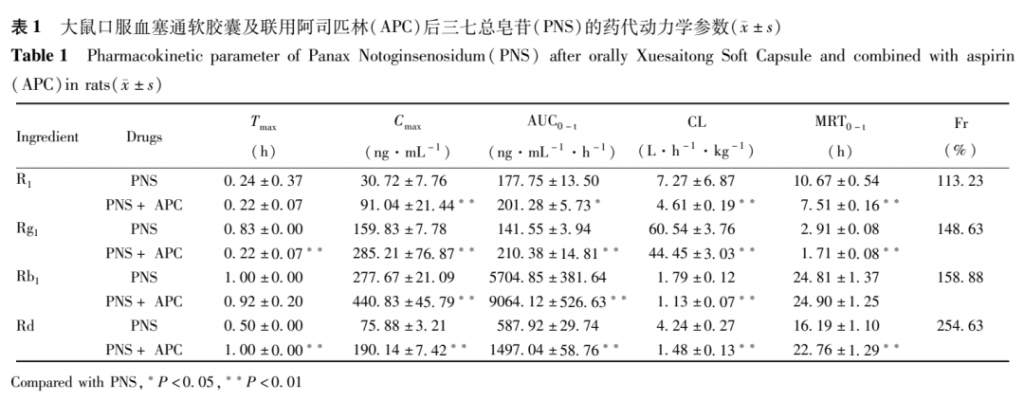
健康Beagle犬(约12kg)用双周期交叉、自身对照实验设计,随机交叉口服血塞通软胶囊或硬胶囊,在相同给药剂量(PNS 600mg)下,口服给予血塞通软/硬胶囊后,两种制剂中的活性成分Re、R1在体内的AUC0-t在不同制剂间比较差异有统计学意义(P<0.05),软胶囊中Re、R1的AUC0-t显著高于硬胶囊,其他3种成分(Rb1、Rd、Rg1)的AUC0-t在两种制剂间比较差异无统计学意义(P>0.05)。
血塞通软/硬胶囊的 5种皂苷成分(Rb1、Rd、Re、Rg1和R1)药代动力学参数Cmax、Tmax在两种制剂比较差异均无统计学意义(均P>0.05)。皂苷成分Rb1、Rd在两种制剂中的Tmax均在6~10h,而Re、Rg1、R1在两种制剂中的达峰相对较快,Tmax为1~3h。两种制剂中皂苷成分Rb1、Rd的Cmax也明显高于Re、Rg1和R1。
3.6 药物相互作用
3.6.1 血塞通软胶囊对阿司匹林的影响
血塞通软胶囊与阿司匹林联用可减轻阿司匹林诱导的胃黏膜损伤,增强阿司匹林的抗血小板作用,其机制与调控花生四烯酸代谢通路有关[27]。在体外实验中,PNS可以抑制Caco-2细胞和HepaRG细胞中阿司匹林水解酯酶活性,对人羧酸酯酶 (human carboxylesterase,hCE)2有较强的抑制作用,对hCE1、丁酰胆碱酯酶和对氧磷酶的影响较小,提示口服PNS类药物可能会抑制阿司匹林在肠道吸收过程中的水解,从而提高其生物利用度[28]。网络药理学研究发现了受 PNS、阿司匹林和6种胃肠道疾病同时影响的27个潜在靶点,PNS的胃肠道保护作用可能与VEGFA的高表达有关[29]。
3.6.2 阿司匹林对血塞通软胶囊的影响
阿司匹林对血塞通软胶囊药代动力学的影响主要发生在吸收过程,阿司匹林和水杨酸能破坏紧密连接蛋白,打开细胞间隙,增加PNS的吸收。血塞通软胶囊与阿司匹林联用时,大鼠体内人参皂苷Rb1、人参皂苷Rg1、人参皂苷Rd、人参皂苷Re和三七皂苷R1的的浓度均有一定程度的增加,表观渗透系数显著增加[26]。
4 血塞通软胶囊的有效性评价
对说明书适应证和超说明书适应证两部分总结药物的临床证据,进行分类评价。
对药品有效性的评价有较为成熟的循证医学方法,本研究基于循证医学标准将临床研究证据分类分级,选择高质量证据作为评价结果。通过随机、盲法和样本量等条件进行筛选,最终纳入有效性评价的文献共18篇,均为RCT研究。
临床有效性的证据评价标准用牛津循证医学中心(Oxford Centre for Evidence – based Mecicine)制定的证据水平(levels of evidence)评价标准(2002年3月),将证据水平2b以上作为纳入评价的质量标准。
4.1 说明书适应证有效性评价)
血塞通软胶囊的说明书功能主治为活血祛瘀、通脉活络。用于瘀血闭脉络证的中风中经络恢复期,症见偏瘫、半身不遂、口舌歪斜、舌强言蹇或不语。或用于心血淤阻型冠心病心绞痛,证见胸闷、胸痛、心慌、舌紫暗或有瘀斑。
4.1.1 上市前临床研究
4.1.1.1 血塞通软胶囊治疗中风Ⅱ期临床验证
针对中风恢复期患者,开展随机表法分组、单盲、对照的临床试验,试验组106例使用血塞通软胶囊2粒/次、2~3次/天;对照组90例为血塞通片,4片/次、2~3次/天,疗程30d。试验结果显示,血塞通软胶囊组总有效率87.25%,对照组总有效率为80.0%,总有效率2组间比较差异无统计学意义(P>0.05)。2组症状体征缓解率均在60%以上,症状积分均明显低于疗前,且试验组较对照组症状积分减少更明显,差异有统计学意义(P<0.01)。血塞通软胶囊治疗后血脂检测总胆固醇、三酰甘油均明显降低[30]。
4.1.1.2 血塞通软胶囊治疗冠心病心绞痛(胸痹)Ⅱ期临床验证
针对冠心病心绞痛(胸痹)患者,开展随机对照临床试验,试验组 106例使用血塞通软胶囊2粒/次、2~3次/天;对照组90例为血塞通片,4片/次、2~3次/天,疗程30d。试验结果显示,血塞通软胶囊组治疗胸痹心痛(冠心病心绞痛)显效27例,有效69例,总有效率为90.57%;对照组总有效率85.56%;对冠心病心绞痛的心电图疗效的总有效率,试验组为82.61%,对照组为75.54%,2组间比较差异无统计学意义(P>0.05)[30]。
4.1.2 上市后临床研究
在说明书适应症上企业研究与已发表的研究均有高质量文献,多为联合用药对比传统治疗研究;单独应用研究较少,且对照均为已上市的中药口服制剂;与阿司匹林联用的效果研究(除新发表的1篇外)均未进行目的性实验设计,新发表的研究例数有限,联用效果提示了增效减毒的作用,但仍需进一步研究。
4.1.2.1 中风(瘀血阻络证)
在对血塞通软胶囊进行的上市后临床研究中,采用了随机、双盲双模拟、阳性药平行对照和多中心研究的方式,考察血塞通软胶囊治疗中风病恢复期(瘀血阻络证)的有效性和安全性,对照组采用丹灯通脑软胶囊(内部资料:血塞通软胶囊治疗中风病恢复期淤血阻络证的多中心、随机双盲研究)。结果显示,血塞通软胶囊组神经功能缺损疗效[美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)]和中医证候疗效与对照组相比均有显著提升,次要疗效“单项症状”中,“上肢不遂”改善明显高于对照组(证据等级1b)。
昌大平等[31]以常规综合治疗(含阿司匹林)为对照,在此基础上加用血塞通软胶囊考察其治疗脑梗死患者的神经功能和生活质量影响。用中国卒中量表(Chinese Stroke Scale,CSS)评价患者的神经功能,并对焦虑自评量表(self-rating anxiety scale,SAS)进行评价,对比2组治疗效果。研究组治疗后总有效率高于对照组,2组治疗后CSS及SAS评分均有降低,且研究组降低更显著(1b)。桂树华等同样以常规综合治疗(含阿司匹林)为对照,在此基础上加用血塞通软胶囊考察其治疗脑梗死患者的疗效。结果发现研究组12个月内脑梗死复发率低于对照组(分别为4%和10%);治疗后6,12个月,研究组不稳定斑块的Crouse评分低于对照组(证据等级1b)[32]。
李薇等[33]探讨了血塞通软胶囊联合阿托伐他汀应用于急性缺血性中风患者的疗效,发现联用组对比常规西医治疗组在总有效率上显著提高,2组药物均能显著降低急性缺血性脑卒中患者的血清总胆固醇、三酰甘油和低密度脂蛋白胆固醇水平,提高高密度脂蛋白胆固醇水平,联合用药效果显著优于常规西药治疗,提示血塞通软胶囊联合阿托伐他汀应用于急性缺血性中风患者疗效显著,血塞通软胶囊与他汀的联合使用具有叠加效应(证据等级1b)。
4.1.2.2 冠心病心绞痛(心血瘀阻证)
在对血塞通软胶囊进行的上市后临床研究中,采用了随机、双盲、双模拟、阳性药平行对照和多中心临床试验的方式,考察血塞通软胶囊治疗冠心病心绞痛(心血瘀阻证)的有效性和安全性,对照组为精制冠心软胶囊。结果表明,28d后心绞痛症状和中医证候与对照组相比均有显著性改善,次要疗效“单项症状中”,第28天“胸痛”“胸闷”“心悸”的全分析集(fullanalysis,FAS)和符合方案集(perprotocol,PPS)与对照组相比有显著改善;而“气短”的FAS和PPS则差异无统计学意义(P>0.05;证据等级1b)。另一项随机对照多中心临床研究中,血塞通软胶囊与血塞通片对心绞痛发作次数、持续时间、中医证候、心电图疗效和血液流变学等均有显著疗效,且在中医证候改善中试验组有显著差异(证据等级1b)[34]。张小艺等[35]在与冠心苏合丸对比研究中也发现,试验组心绞痛疗效、心电图疗效的显效率及总有效率均高于对照组(证据等级1b)。
姜利鲲等[36]在探析用血塞通软胶囊治疗冠心病心绞痛的效果中发现,在常规治疗上加用血塞通软胶囊,可显著提高治疗的总有效率并降低每周心绞痛发作的次数及每次心绞痛发作持续的时间(证据等级2a)。叶睿[37]同样使用血塞通软胶囊治疗冠心病心绞痛考察临床疗效,并摸索与之配合的有效护理方法,对照为常规疗法(含阿司匹林)。发现当配合以得当的护理方法后,血塞通软胶囊治疗冠心病心绞痛的有效率可提升至94%,且心电图显示的治疗有效率也可达到73%,显著优于对照组患者;同时,在硝酸甘油用药量方面,治疗组患者较对照组患者减少得更为显著(证据等级2a)。冠心病心绞痛患者使用血塞通软胶囊进行辅助治疗的效果显著,可改善其心绞痛的症状。
在最新发表的一项纳入稳定冠心病合并慢性胃炎患者的随机、双盲对照试验中,试验组用PNS(血塞通软胶囊)+阿司匹林的治疗方法,对照组仅用阿司匹林治疗,为期2个月。消化不良严重程度评估(severity of dyspepsia assessment,SODA)结果显示,与阿司匹林组相比,PNS+阿司匹林组患者消化不良症状减轻,其机制与胃泌素和胃动素分泌增强有关。与单独阿司匹林相比,PNS+阿司匹林进一步抑制CD62p表达、糖蛋白(glycoprotein,GP)Ⅱb-Ⅲa激活和血小板聚集。与单独阿司匹林相比,PNS+阿司匹林抑制血小板COX-1活性,降低血小板中花生四烯酸或COX-1通路下游氧脂TXB2、PGD2、PGE2、11-HETE的生成[38](证据等级1b)。研究结果提示,PNS与阿司匹林联用在治疗冠心病与单独应用阿司匹林相比,有进一步增强抑制血栓形成和减轻胃黏膜损伤的作用,但仍需进一步研究。
4.2 超说明书适应证用药
4.2.1 心脑血管疾病
冠心病是引起心力衰竭的独立危险因素,据权威数据显示,在各类心力衰竭的诱因中,冠心病的比例超过了50%。徐桂贤[39]通过RCT分析血塞通软胶囊对改善冠心病合并慢性心力衰竭患者运动耐力和生活质量的积极作用,发现在常规西医治疗基础上应用血塞通软胶囊对患者的心率、收缩压均有显著的改善;另一方面,在治疗后6min步行试验和生活质量评分方面比较,加用血塞通软胶囊组也占据明显的优势(证据等级2a)。
研究发现,在高血压常规治疗基础上联用血塞通软胶囊可显著提高治疗效果。刘晖等[40]在波依定基础上联用血塞通软胶囊,发现联用组与单用波依定组相比总有效率显著提高,收缩压、舒张压显著降低,血浆血管紧张素Ⅱ、内皮素水平明显下降(1b)。林艳珍[41]在阿司匹林肠溶片基础上联用血塞通软胶囊,探讨血塞通软胶囊治疗高血压性视网膜病变的临床疗效,发现治疗组对视网膜病变有显著疗效,能减少出血,提高视力,总有效率明显高于对照组,差异有统计学意义(P<0.05)。2组在治疗后血压均较治疗前下降,治疗组血压控制更好,基本上收缩压保持在140mmHg以内,舒张压保持在90mmHg以内。提示血塞通软胶囊治疗高血压性视网膜病变的临床疗效确切,可有效改善患者的临床症状和血压水平,提高生活质量(证据等级 1b)。
丁俊荣[42]在阿司匹林和辛伐他丁的基础上联用血塞通软胶囊考察治疗动脉粥样硬化的临床疗效,发现2组治疗后软斑性质、数目和体积均较治疗前明显改善,且治疗组优于对照组。且治疗6个月,随访1年,治疗组心脑血管事件发生和再入院次数较对照组明显减少(证据等级1b)。
许军等[43]采用血塞通软胶囊 +阿司匹林安慰剂对比血塞通软胶囊安慰剂 +阿司匹林评估高黏血症的临床疗效。结果发现试验组治疗总有效率(86.67%)显著高于对照组(56.67%)。2组治疗后PADT、PAGT、TXB2及6-keto-PGF1α,与治疗前比较,差异均有统计学意义 (均 P<0.05)。试验组CD62P及CD41治疗后明显下降,而对照组CD62P及CD41则差异无统计学意义(P>0.05)。2组治疗前后胆固醇(TC)无明显变化,三酰甘油(TG)及极低密度脂蛋白胆固醇(VLDL-C)均有不同程度的降低,但与治疗前比较,差异无统计学意义(P>0.05;证据等级1b)。
吴怡琼等[44]在给予西医常规治疗基础上加用血塞通软胶囊观察血塞通软胶囊辅助治疗血瘀型心悸的疗效。发现与西医常规治疗组相比,联合用药组中医证候积分、心电图均有明显改善(证据等级2a)。
李博等[45]采用单中心、随机双盲双模拟,将慢性脑供血不足患者分为 2组,用银杏叶软胶囊为对照组。血塞通软胶囊组的双侧椎动脉血流改善幅度和左右椎动脉收缩期峰速度(PSV)均有明显改善。提示血塞通软胶囊治疗慢性脑供血不足略优于银杏叶胶囊(证据等级 1b)。
4.2.2 糖尿病
李新杰等[46]通过随机数字表法将早期糖尿病肾病患者随机分成对照组、血塞通软胶囊组、缬沙坦组和联用组,观察血塞通软胶囊与缬沙坦对早期糖尿病肾病炎性因子的影响。结果发现,血塞通软胶囊联合缬沙坦可通过降低超敏C反应蛋白 (hs-CRP)、IL-6、TNF-α水平抑制炎性反应,减少尿微量清蛋白的排泄,达到对早期糖尿病肾病的保护作用(证据等级 2b)。王朝飞[47]通过随机分组观察血塞通软胶囊治疗糖尿病周围神经病变的疗效,发现研究组治疗总有效率优于对照组,在改善症状、控制血糖和改善血液流变学指标方面具有显著疗效(证据等级2a)。张秀丽等[48]在糖尿病基础治疗并加用有效抗菌药物、清疮等综合治疗同时,2组均予舒血宁注射液静脉滴注,治疗组配伍血塞通软胶囊,观察常规疗法联合血塞通软胶囊治疗糖尿病足早期的临床疗效。结果治疗组总有效率80.71%,对照组总有效率 66.73%,提示常规治疗联合血塞通软胶囊可显著改善糖尿病足的不适症状,延缓其病程,促进创面愈合(证据等级2a)。
4.2.3 其他疾病
佟攀峰[49]将患者随机分为盐酸氟桂利嗪胶囊组和与血塞通软胶囊联合用药组,探讨联合使用盐酸氟桂利嗪胶囊和血塞通软胶囊对老年偏头痛患者进行治疗的临床效果。结果发现联合用药组患者治疗的总有效率明显高于单独用药组患者,差异有统计学意义(P<0.05)。提示联合使用盐酸氟桂利嗪胶囊和血塞通软胶囊对老年偏头痛患者进行治疗的效果显著(证据等级2a)。王艳艳[50]采用血塞通软胶囊与维生素 E丸、维生素 C片作对照观察血塞通软胶囊治疗老年性黄斑变性的效果,发现血塞通软胶囊有效率显著高于对照组,提示其治疗年龄相关性黄斑变性方便可靠(证据等级2a)。
5 血塞通软胶囊的安全性评价
血塞通软胶囊安全性研究文献筛选后最终纳入文献共14篇,均为RCT研究,真实世界研究、病例系列研究、药物不良反应(ADR)个案报道和系统综述未见报道。将26篇包含安全性或不良反应的研究进行去除重复与无关文献筛选后共计纳入14篇研究,均为RCT研 究。对纳入研究进行信息录入和采用Cochrane推荐的“偏倚风险评估”工具,对RCT研究的文献质量进行评价。
安全性在临床前毒理中研究较多,且上市后进行的大量研究补充。临床研究主要是国内临床申报试验和美国开展的一项 I期研究。上市后药品安全性数据主要来源于企业的每年监控报告,企业开展的上市后研究中也有对安全性和ADR的观察,但血塞通软胶囊与对照组比较差异无统计学意义(P<0.05)。发表的研究中尚未有以血塞通软胶囊安全性为主要目的的文献,纳入评价的研究中安全性结果均为有效性研究的次要结果。
5.1 药品上市前安全性评价
5.1.1 毒理学研究
5.1.1.1 急性毒性研究
小鼠测出半数致死剂量为6784.2mg•kg-1,95%可信度8460.2~5108.2mg•kg-1,半数致死量约为成人临床用量的130倍[30],临床用量安全。
上市后企业对药品进行了补充研究,间隔24h连续2d灌胃,未见对小鼠染色体具有损伤作用;未发现对测试菌致突变作用;细胞培养:将 4个质量浓度(10,20,40,80μg•mL-1)折算药物剂量(为7.05,14.10,28.20,56.40μg•mL-1)未诱发中国仓鼠卵巢细胞染色体畸变率增高,无遗传毒性。单次灌胃:3个质量浓度(50,100,200mg•kg-1)分别相当于临床拟用剂量的12.3,25,50倍,对小鼠运动协调能力无明显影响,对小鼠自主活动无明显影响。单次灌胃:2个质量浓度(8,80mg•kg-1)分别相当于临床拟用剂量的2,20倍,对Beagle犬心血管系统和呼吸功能无明显影响,无明显急性毒性反应。
5.1.1.2 长期毒性研究
按成人用药剂量的60倍为高剂量组、20倍为低剂量组,随机编为3组:空白对照组和高低2个剂量给药组,每组20只。分 别 用Wister大 鼠(体重90~120g,雌雄各半),每日用本品灌胃连续90d(按体重1mL•kg-1)。实验结果显示,90d中无 1例死亡,各组体重增长基本一致,活动行为、皮毛、食量与粪便均正常;病理组织学检查发现,各组动物的肝、肺、肾、心、脾、肾上腺均未见病理变化;血液指标检查各组与空白对照组比较差异无统计学意义(P>0.05),表明无毒性反应[30]。
上市后企业对长期毒性进行了补充研究,血塞通软胶囊连续 2周口服,在剂量为180mg•kg-1时,对大鼠无明显的毒效应;对Beagle犬的安全剂量为150mg•kg-1•d-1以下剂量。长期高剂量用药可能的毒性靶器官或靶组织为胃肠道和肝,其中肝脂肪变性可能与供试品的溶媒成分植物油相关;每周6d,6个月反复给药,大鼠最大无毒性反应剂量为85mg•kg-1。
5.1.2 上市前临床研究的安全性评价
根据新药申报时临床验证,治疗组208例(中风102例,冠心病心绞痛106例)的观察,均未发现不良反应,治疗前后血、尿、粪便和肝肾功能均属正常[30]。
血塞通软胶囊于美国开展的一项用以评价在健康志愿者中的安全性和耐受性的Ⅰ期临床研究,研究设计为开放标签、单次给药和剂量递增研究,18例健康成年男性和女性受试者在本研究期间接受 1次血塞通软胶囊给药,各剂量队列各有 3例受试者接受120,240,480,和720mg研究药物单次给药,有 6例受试者接受1080mg研究药物单次给药。结果显示,在单次给药剂量不超过1080mg的情况下是安全的,且耐受性良好。未报告严重不良事件,无受试者因不良事件中断研究治疗。在本研究期间,安全性实验室数值、生命体征评估结果或十二导联心电监测结果随着观测时间延长并无临床显著性趋势或产生个体变更。
5.2 药品上市后安全性评价
5.2.1 药品上市后企业临床研究的ADR发生率
在血塞通软胶囊的上市后研究中,治疗冠心病心绞痛(心血瘀阻证)的有效性和安全性研究试验的165例受试者中,仅有1例发生不良反应事件,ADR发生率为0.61%。在治疗中风病恢复期(瘀血阻络证)的有效性和安全性的试验中,156例受试者治疗前后血、尿、粪便、肝肾功能均属正常,未见ADR发生。
5.2.2 文献报道的ADR
血塞通软胶囊临床上主要用来防治冠心病、心绞痛和缺血性中风等多种疾病。根据上市后临床研究文献中的ADR信息,血塞通软胶囊导致的ADR临床表现通常为轻中度且是暂时的症状,主要为腹胀、上腹不适、头昏、呕吐、皮肤瘙痒和皮疹等。证据出自有效性研究的次要结果,样本量小,证据级别低[35,40,42-43]。
有研究对血塞通软胶囊临床1189例ADR的临床观察,涉及北京、上海、重庆、昆明和保定等城市,共16个医院,7个科室,13个病种,结果均未发现ADR。通过既往文献的检索,急性毒性、长期毒性实验,以及临床多中心大数量的ADR观察,均未发现毒副作用或ADR。同时尚未发现与某些药物的配伍禁忌,包括口服舒脑宁、维生素C和维生素E,以及静脉滴注脑复康或降压药、降糖药和抗菌药物等[30]。
5.2.3 药品监管部门和企业收集的ADR信息
在2013年1月1日至2020年4月30日,用药人数超过2500万人次,共收到血塞通软胶囊ADR报告296例,包括国家药监局反馈数据285例及企业自主收集病例11例,报告人评价为“可能无关”或“待评价/无法评价”的22例。患者转归信息显示,145例病例患者痊愈144例病例患者好转,4例转归不详,3例患者未好转,未好转为病例的 ADR表现为皮疹、瘙痒及眩晕。
大部分ADR报告程度为“一般”。主要表现如下。(1)胃肠系统症状,具体表现为胃不适、恶心、腹痛、腹胀、腹泻、恶心呕吐、便秘和食欲异常等。部分患者的肠胃系统反应伴随头晕、头痛、胸闷和皮疹等症状。(2)皮肤及其附件症状,具体表现为皮疹、荨麻疹、瘙痒、斑丘疹、红疹、过敏性皮炎、药疹和过敏反应等。(3)中枢外周神经系统症状,具体表现为头晕、头痛、嗜睡和失眠焦虑等。部分患者伴随胃肠系统损害如恶心、胃胀和腹泻等。导致住院或住院时间延长/导致其他重要医学事件的 ADR有10例,包括9例国家药监局反馈数据(报告人评价均为“可能”或“很可能”)及 1例自主收集病例 (报告人评价为 “可能无关”)。
5.3 血塞通软胶囊的质量评价
药品质量评价包括药品的质量标准、质量抽检信息、上市后的质量评价文献、原辅料与工艺、认证与研究报告、与质量相关的风险管理情况及药物警戒情况和特定药物分类或剂型等需重点考虑的项目等内容。
5.3.1 原材料质量控制
昆明华润圣火药业有限公司生产的血塞通软胶囊采用云南道地药材三七为原料,是该公司与其他相关方联合组建的定点生产基地,种植与采收全过程均按良好农业规范(GAP)要求[42-43]。
5.3.2 药品的质量控制
5.3.2.1 生产厂家的良好操作规范认证和实施
经国家药品监督管理局官网查询,血塞通软胶囊(每粒含三七总皂苷 60mg)的生产厂家昆明华润圣火药业有限公司已获得包含中药前处理和提取、软胶囊剂的良好操作规范 (good manufacturing practice,GMP)认证,最新发证日期为2019年4月22日,有效期 5年。厂家严格按照《药品生产质量管理规范》进行药品生产,建立了完善的质量管理体系。
5.3.2.2 质量标准
血塞通软胶囊(每粒含三七总皂苷60mg)执行国家药品监督管理局国家药品标准[WS3-182(Z-25)-2002(Z)]。本品每粒(每粒含三七总皂苷60mg)含人参皂苷Rb1不得少于16.0mg、含人参皂苷Rg1不得少于12.0mg、含三七皂苷R1不得少于3.0mg,且人参皂苷Rb1、人参皂苷Rg1和三七皂苷R1的总量不得少于32.0mg。
5.3.3 上市药品的质量检验
昆明市食品药品检验所提供了最新药品检验报告,根据国家药品监督管理局国家药品标准[WS3-182(Z-25)-2002(Z)]对铝塑包装 (批 号:20190509)和瓶装(批号:20191417)的血塞通软胶囊(每粒含三七总皂苷60mg)进行抽样检验,结果均符合规定。
6 血塞通软胶囊的经济性评价
根据文献主题和关键词筛选药物经济学研究主题文献 2篇,最终经质量评价后纳入文献 2篇。经济性的证据质量评价标准采用卫生经济学评价报告指南中的卫生经济学评价报告标准共识 (CHEERS)清单。
6.1 脑梗死
在北京大学医药管理国际研究中心开展的血塞通软胶囊治疗脑梗死的循证药物经济学评价中,纳入18个血塞通软胶囊联合常规西药治疗脑梗死的RCT的系统评价,采用成本 -效果分析对 2组不同治疗队列患者进行药物经济学分析,对照为常规西药治疗(内部资料:血塞通软胶囊治疗脑梗死基于文献的成本-效果分析.北京大学医药管理国际研究中心)。结果发现,与西医常规方案相比,血塞通软胶囊联合西医常规方案治疗脑梗死的短期临床有效性更好,成本更高。药物的经济性优势取决于决策者对健康产出的支付意愿,综合 4个健康产出的增量成本-效果比(ICER),当支付意愿大于95.6元的时候,血塞通软胶囊联合西医常规治疗方案更具有成本-效果优势。
6.2 冠心病心绞痛(心血瘀阻证)
在中国中药协会中药药物经济学专业委员会开展的血塞通软胶囊治疗冠心病心绞痛(心血瘀阻证)的药物经济学评价中,采取前瞻性真实世界研究设计,在临床实际诊疗情况下,无干预收集患者的药物经济学成本、临床产出等方面的资料。采用成本-效果分析和成本-效用分析对2组不同治疗队列患者进行药物经济学分析,对照为血塞通胶囊(内部资料:血塞通软胶囊治疗冠心病心绞痛基于前瞻性真实世界研究成本-效果分析和成本-效用分析.中国中药协会中药药物经济学专业委员会)。
成本-效果分析采用最优效果考察经济顺位,试验组在中医证候疗效及总有效率、冠心病心绞痛发作次数及发作次数总有效率、冠心病发作严重程度及严重程度总有效率和患者满意度方面优于对照组,即血塞通软胶囊的药物经济性优于血塞通胶囊。
经增量成本-效用分析,试验组每多获得一个单位效用值,需要多花费的增量成本低于2013年人均国内生产总值(GDP)的43000元(总样本人群增量成本为33214.19元,联合用药人群增量成本41131.87元)。而无联合用药样本人群分析显示:血塞通软胶囊组不仅质量调整生命年(QALY)值高于血塞通胶囊组(3.39×10-3vs 0.8×10-3元),且治疗成本低于血塞通胶囊组(493.67元 vs 519.33元),每多获得 1个单位效用值,血塞通软胶囊组可以节省100.78×102元,即血塞通软胶囊的药物经济性优于血塞通胶囊。
血塞通软胶囊在改善冠心病心绞痛的效果指标中医证候疗效、心绞痛症状改善的效果指标及效用指标的改善方面,其经济性均优于血塞通胶囊。
7 适宜性评价
7.1 药品技术特点适宜性
7.1.1 说明书及标签信息规范性
药品说明书是临床医师和药师指导患者合理用药的法定依据,是合理使用、管理药品的重要指南。药品说明书和标签规范与否,直接影响药品的合理正确使用和用药安全。因此参照《药品说明书和标签管理规定》(国家食品药品监督管理局令第24号)《中药、天然药物处方药说明书撰写指导原则》等规定对药品说明书和标签的规范性进行评价。
7.1.1.1 说明书规范性
血塞通软胶囊(每粒含三七总皂苷60mg)药品说明书“药品例称”“成分”“性状”“功能主治”“规格”“用法用量”“禁忌”“药理作用”“贮藏”“包装”“有效期”“执行标准”“批准文号”“生产企业”信息规范,其中功能主治描述包含西医病例和中医证候,较易理解;用法用量“2粒/次,2次/天”的描述对用药的指导不具体,如服用时间、儿童用法用量等信息需要完善。“ADR”和“注意事项”两项信息均显示“尚不明确”,需要补充完善。
时效性方面,血塞通软胶囊(每粒含三七总皂苷60mg)的核准日期为2006年12月6日,修改日期为2018年2月1日,更新频率较低,最近更新时间为3年之前。
7.1.1.2 标签信息规范性
药品说明书和标签中的药品例称符合国家食品药品监督管理总局公布的药品通用例称和商品例称的命例原则,并与药品批准证明文件的内容相一致。药品包装上的标签为横版,通用例称在上1/3范围内同行显著标出,字体背景反差强烈易辨识。药品商品例在通用例称左上 1行,单字体面积未超过通用例称单字体的1/2。
药品最小包装为药用铝塑包装,便于药品的调配和储存。药品的外标签信息内容与说明书内容一致。
7.2 药品使用适宜性
患者顺应性 根据药学特性,血塞通软胶囊为口服制剂,无苦味,每日用量和服用次数较少,减少咽部刺激,服用简单方便。但未发现血塞通软胶囊患者顺应性评价的文献报道。
医务人员顺应性 目前未查询到直接评价医务人员使用血塞通软胶囊的顺应性的文献报道。
7.3 指南评价
根据国家卫生健康委员会医管中心标准处在国外公认的AGREE Ⅱ框架下、制定的具有实质等效的中国临床实践指南评价体系AGREE-China)[51],对指南的评价从科学性/严谨性、有效性/安全性、经济性、可用性/可行性和利益冲突等方面共计15个条目进行评估。
中国脑卒中合理用药指导规范2019年1月发布,由国家卫生健康委脑卒中防治工程委员会制定,在第四部分脑卒中合理用药附表 5(常用中成药)中推荐应用血塞通软胶囊,推荐内容同说明书功能主治。属于政府卫生健康机构推荐,推荐等级强,但评价格式不适用于一般的指南评价。冠心病稳定型心绞痛中医诊疗指南[52]2019年11月发布,由中华中医药学会心血管病分会制定,在冠心病稳定型心绞痛心血瘀阻证治疗中推荐应用血塞通软胶囊,证据级别GRADE系统B级(证据质量中),推荐强度为有条件推荐。指南评价分数为53分,对指南的推荐程度为弱推荐。糖尿病周围神经病变中医临床诊疗指南[53]2017年4月发布,由中华中医药学会糖尿病分会制定,在糖尿病周围神经病变痰瘀阻络证治疗中推荐应用血塞通软胶囊,证据级别为Ⅱa级,推荐强度为弱推荐。指南评价分数为53分,对指南的推荐程度为弱推荐。
8 可及性评价
8.1 价格
通过米内网检索血塞通软胶囊招投标信息,以最新中标时间(2020年11月9日)为准,单价最低为1.00元,平均价1.71元,中值为1.79元,高值为3.00元。最低价与最高价差值不大,中值与平均值较为接近,药品价格适宜稳定。
8.2 可获得性
血塞通软胶囊(每粒含三七总皂苷60mg)产品线成熟,生产规模较大,贮藏条件为密封,置阴凉处(不超过20℃),有效期较长(36个月)。在全国29个省(市、区)的医院、基层医疗机构和药店均有销售,市场覆盖率高,药品可获得性高。
8.3 可负担性
血塞通软胶囊(每粒含三七总皂苷60mg)为中药保护品种,已纳入国家医保2020版(乙类)中,可为患者减轻负担。
9 创新性评价
9.1 创新奖项
以血塞通软胶囊(每粒含三七总皂苷60mg)为核心研究内容的“中药大品种三七综合开发的关键技术创建与产业化应用”荣获2016年度中华中医药学会科技进步一等奖、2017年度国家科技进步二等奖。血塞通软胶囊(每粒含三七总皂苷60mg)已顺利通过美国食品药物管理局Ⅰ期、Ⅱ和Ⅲ期临床试验,关键技术于2018年获国家“十三五”重大新药创制专项立项支持。
9.2 专利情况
血塞通软胶囊(每粒含三七总皂苷60mg)共获得中国发明专利 3件,实用新型专利 9件;获得美国发明专利 1件。中国发明专利2012年,一种血塞通软胶囊的临床新用途;2018年,一种血塞通软胶囊的检测方法和制备方法;2020年,一种软胶囊的溶出度检测方法。美国发明专利:2012年,一种治疗血液循环障碍的制剂和方法。实用新型专利:2018年,一种酒精回收储存装置;2018年,一种酒精回收系统;2018年,一种铝塑包装机;2018年,一种铝塑包装机补药装置;2018年,一种软胶囊输送机;2018年,一种树脂清洗装置;2018年,一种抬料小车;2018年,一种物料收集房;2018年,一种铝塑包装机在线拣选装置。
9.3 解决临床需求
目前抗血小板药物仍被国内外心脑血管疾病防治指南广泛推荐,包括单抗或者双抗。临床实践证实,无论是单抗还是双抗,均存在药物抵抗、出血风险和胃肠损伤等缺陷,亟需疗效更优、安全性更佳的临床解决方案。在动物药代动力学研究中,血塞通软胶囊(每粒含三七总皂苷60mg)联合阿司匹林能相互促吸收。药理学研究结果显示,血塞通软胶囊(每粒含三七总皂苷60mg)与单抗或双抗联合用于脑卒中或冠心病动物模型及人体临床研究,均优于单独使用单抗或双抗疗法,起到显著的增效减毒作用。阿司匹林/阿托伐他汀与血塞通软胶囊联合应用的中西医结合临床用药方案为临床心血管疾病治疗提供一种方法学优化方案。
10 评价结果
药学特性:研究较为全面。血塞通软胶囊及其主要成分的药学特性研究文献量很大,研究证据覆盖有效成分、药理效应、作用机制、药代、药物相互作用及剂型特征等各个方面,证据链条比较完整。
有效性:证据较多,获指南推荐。血塞通软胶囊的临床研究充足,证据质量评价显示,相对高质量证据的原始研究有18篇,分布在11个子领域,以说明书适应证冠心病心绞痛和中风为主,获多个中西医临床诊疗规范和指南推荐。由于具有较为广泛深入的基础研究,血塞通软胶囊在临床上的应用范围还扩展到了其他心脑血管疾病、糖尿病并发症、偏头痛和黄斑疾患等疾病领域。说明书适应证外的有效性研究以心脑血管疾病为主,文献数量较少,证据级别偏低。
安全性:证据充分,ADR发生率低,质量达标且可控,具有完善的质量管理体系。血塞通软胶囊上市前和上市后安全性方面的研究较为全面,ADR发生率低,药品监管部门和企业收集的ADR信息与现有文献中偶见报道的类型相重合。ADR临床表现主要包括胃肠系统症状、皮肤及其附件症状,通常是轻度而且是暂时的。
经济性:在说明书功能主治中有获益,有待更新。血塞通软胶囊的经济学评价证据数量不多,血塞通软胶囊的药物经济学评价主要分布于中风和冠心病心绞痛两大领域,血塞通软胶囊治疗冠心病心绞痛在成本 -效果和成本 -效用方面均优于血塞通胶囊。与西医常规方案相比,血塞通软胶囊治疗中风的药物经济性优势取决于决策者对健康产出的支付意愿,综合4个健康产出的ICER,当支付意愿大于95.6元的时候,血塞通软胶囊联合西医常规治疗方案更具有成本-效果优势。
适宜性:患者和医务人员直接证据缺乏,标签信息内容合规,说明书有待完善。血塞通软胶囊无苦味,每日用量和服用次数较少,减少咽部刺激,生物利用度高,减少药物胃内降解,有利于药物肠内吸收,推测其患者依从性和医务人员顺应性较高,但缺乏直接证据。血塞通软胶囊的说明书内容、内标签和外标签的信息标注均符合现行规定,但说明书中ADR和注意事项均显示“尚不明确”,需要补充完善。
可及性:中招投标信息显示价格平稳;生产规模和市场覆盖大、贮藏运输条件适宜可获得性强;国家医保乙类支付,具有一定的可负担性。
创新性:获得多项创新奖项和产品技术专利,与指南推荐的单抗双抗联用可能达到改善药物抵抗、出血风险、胃肠损伤等缺陷,达到增效减毒作用。
编写专家组及参考文献见原文(点击文末“阅读原文”下载原文件)
声明:登载此文章目的为更广泛的传递行业信息,不代表赞同其观点或对其真实性负责。文章版权归原作者及原出处所有,文章内容仅供参考。本网拥有对此声明的最终解释权,若无意侵犯版权,请联系小编删除。若有不同意见,也欢迎留言反馈,谢谢。
摘 要
目的:以注射用丹参多酚酸盐为例,探索中药注射剂的综合评价方法,为今后相关工作的开展和完善提供参考。
方法:通过文献检索和获取相关文献资料,从药学特性、质量等方面对注射用丹参多酚酸盐进行药学综合评价。
结果:在有效成分和药物作用机制方面,丹参多酚酸盐已经进行了大量的基础研究。质量方面的文献证据也较为丰富。
结论:注射用丹参多酚酸盐在药学特性方面研究探索面非常广,相关基础研究还有待进一步探索。
药品临床综合评价是促进药品回归临床价值的基础性工作,新一轮党和国家机构改革将开展药品临床综合评价确定为卫生健康部门的法定职责,《“健康中国2030”规划纲要》、《“十三五”卫生与健康规划》等文件也对药物临床综合评价提出了明确要求。药学评价是药品综合评价的重要组成部分,对药品药学特性的研究可以促进临床安全合理用药,药品质量评价则是考察药品临床使用的重要参考指标。
丹参是一种活血化瘀的常用中药,被广泛应用于各种单方及复方中成药的制备与临床应用,如丹参注射液、复方丹参滴丸、复方丹参片、丹红注射液等,涉及注射剂、口服制剂、喷雾剂等不同剂型。尽管上述药品都源于丹参,不同产品的制备工艺、质量标准均不完全相同。由于丹参中多酚酸类成分普遍对热、酸碱度、溶液状态不稳定,制备工艺中高温、酸碱处理、水溶液制剂对丹参的水溶性成分变化、降解有很大的影响,使得最终药品所含的化学成分或者有效成分差异极大。如复方丹参片以丹参酮IIA,丹酚酸B为质量控制指标[1],复方丹参滴丸以丹参素为质量控制指标[2]。即使是同为丹参注射剂,还包含以丹参素为质量控制指标的注射剂,和以丹参酮IIA磺酸盐为质量控制指标的注射剂,从物质基础角度来看,上述为完全不同的药品。可以说,以丹参为源头,生产出了一系列成分、质量不一而同的药品。
注射用丹参多酚酸盐是一种临床应用广泛的注射用丹参制剂,主要用于心脑血管疾病的治疗。有别于其他所有的丹参制剂,注射用丹参多酚酸盐的有效成分是唯一一个以丹参乙酸镁为主要成分的多酚酸盐类成分,其中丹参乙酸镁的含量大于80%,余下的为紫草酸盐和迷迭香酸盐等次要成分,成分和质量的明确性和可控性是中药制剂中较为少有的。尤其是天然镁盐特征的保留使得丹参多酚酸盐在质量、疗效和安全性上具有独特的优势,而疗效和安全性的临床表现优势则促进了药物经济学的优势[3]。
本研究以注射用丹参多酚酸盐为例,尝试探索中药注射剂在药学特性方面的综合评价方法,以期为今后相关工作的开展和完善提供参考[4-5]。
1 资料与方法
中国药品综合评价指南项目组编写的《中国药品综合评价指南参考大纲(第二版)》(2015)[6],从药品的安全性、有效性、顺应性及药物经济学等9个方面建立了药品评价的方法,形成了较为完整的药品评价体系。本研究采用该指南中的评价指标,从药品的药学特性、质量等维度对药品进行药学综合评价。
1.1 药学特性评价文献检索方法及结果
按检索目的及要求,在中国知网、万方数据库、 web af science 平数据库(Medline 数据库)、EM- BASE数据库、Elsevier、Wiley 等主要数据库中,以“丹参多酚酸盐”或“丹参乙酸镁”等作为主题词进行检索。经过人工甄别,最终纳入研究文献879篇。根据文献主题及相关性筛选,最终药学特性评价纳入文献235篇,药学特性评价主要评价药品的有效成分、药理作用机制、药动学、药效动力学、药物相互作用和剂型特征等方面。
1.2 质量评价文献资料来源
药品质量评价的主要文献来源为企业提供的质检报告、内控质量标准等文件资料。评价内容包括药品质量控制体系评价和药品质量结果指标评价,具体包括药品的质量标准、药品检验机构的质量抽检信息、上市后的质量评价文献、原辅料与工艺、认证与研究报告、与质量相关的风险管理情况及药物警戒情况、特定药物分类或剂型等需重点考虑的项目等内容[7]。
2 注射用丹参多酚酸盐的药学特性评价
2.1 有效成分
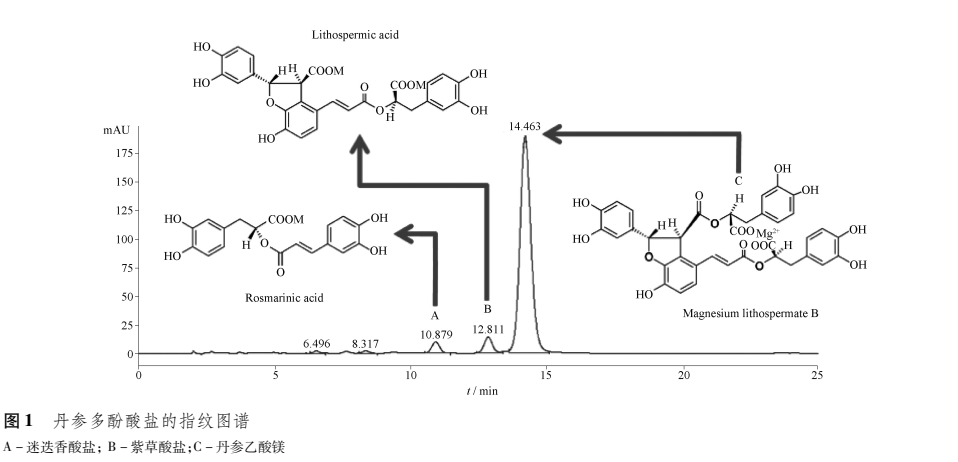
注射用丹参多酚酸盐为淡黄色疏松体,易溶于水、醇,难溶于丙酮。丹参乙酸镁为主要成分(80%-90%),紫草酸盐、迷迭香酸盐为次要成分(10% -20%),其他的多酚酸盐成分均为小于1%的微量成分。因此,以丹参乙酸镁的含量作为丹参多酚酸盐及其粉针剂的质控标准,从面保障了产品质量均一性和疗效的稳定[8]。
2.2 药理作用机制
注射用丹参多酚酸盐为淡黄色疏松体,易溶于水、醇,难溶于丙酮。丹参乙酸镁为主要成分(80%-90%),紫草酸盐、迷迭香酸盐为次要成分(10% -20%),其他的多酚酸盐成分均为小于1%的微量成分。因此,以丹参乙酸镁的含量作为丹参多酚酸盐及其粉针剂的质控标准,从面保障了产品质量均一性和疗效的稳定[8]。
丹参(Radix Salvia Miltiorrhiza)的活性成分主要分为水溶性和脂溶性两大类,水溶性成分包括丹参素、咖啡酸、迷迭香酸、紫草酸以及丹酚酸类化合物等。临床前和临床研究结果显示,丹参中水溶性成分丹酚酸B(salvianolic acid B,Sal B)及其镁盐丹酚酸B镁(magnesium lithospermate B,MLB)活性最为突出,临床用于冠心病稳定型心绞痛治疗的注射用丹参多酚酸盐中80% 成分就是 MLB。因此,围绕 MLB的药理机制研究对未来丹参多酚酸盐的临床应用和机制解释将有着极强的参考意义。
2.2.1 对心血管保护作用
丹参多酚酸盐对心血管系统具有非常广泛的药理作用,如清除缺血部位的自由基、保护血管内皮损伤,抗动脉粥样硬化;改善微循环,减轻心肌缺血损伤;抗血小板聚集及黏附,扩张冠状动脉,增加冠脉流量,保护心脏功能等[9-10]。
2.2.2 抗炎作用
研究显示,丹参多酚酸盐可有效降低ACS患者血清hs-CRP 及TNF-α水平,减轻炎症反应,抑制动脉粥样硬化进展[11]。此外,降低 ACS患者的抵抗素水平、抑制CRP的产生,同时升高脂联素的水平,是丹参多酚酸盐抗炎、抗AS的重要作用机制之一[12]。
2.2.3 自由基清除和抗氧化作用
丹参多酚酸盐能够明显抑制CuSO4和内皮细胞(HMEC)诱导的 LDL 氧化修饰,提示丹参多酚酸盐抑制脂质过氧化[13]。此外,丹参多酚酸盐可以有效改善心肌缺血再灌注损伤大鼠抗氧化酶(SOD、CAT)活性并降低MDA 含量[14],同时有助于提高氧化物歧化酶以及谷胱甘肽过氧化物酶水平,具有抑制离体心脏缺血再灌注后氧化应激损伤的作用[15]。研究表明,丹酚酸B在实验应用浓度范围内对缺血/再灌注引起的心肌细胞损伤具有一定的保护作用,减轻了缺血/再灌注引起的心肌细胞超微结构损伤,其作用机制可能与清除自由基的作用密切相关[16]。
2.2.4 抗血小板聚集及黏附抑制血栓形成
丹参多酚酸盐对二磷酸腺苷(ADP)和肾上腺素(EP)诱导的血小板聚集和活化具有明显的抑制作用,进而产生抗血栓效应[17]。MLB(50~800mg·L-1)通过抑制凝血酶和花生四烯酸诱导的兔血小板聚集,抑制静息状态下和凝血酶刺激下血小板中的[Ca2+]升高,从而抑制血小板聚集[18]。
2.2.5 预防脑缺血-再灌注损伤和神经变性
在急性局灶性脑缺血再灌注大鼠中,MLB通过减少脂质过氧化物、清除自由基和改善能量代谢,对缺血缺氧引起的神经细胞损伤有明确的保护作用,保护大脑免受缺血再灌注损伤[19]。MLB与Na+/K+-ATP酶 α亚单位胞外结合抑制Na+/K+-ATP酶活性,进而促进血液循环,对缺血性脑卒中发挥神经保护作用[20]。
2.2.6 其他作用
此外,MLB 还可以改善肾功能及预防糖尿病肾病[21-23];通过抗氧化、抑制HSC增殖等,抑制肝纤维化[24-27];通过干预减轻肺损伤程度,提示其对 ALI/ARDS 有防治作用[28]。丹参多酚酸盐具有增强肠黏膜局部免疫功能[29],缓解肠道炎性[30],降低术后肠黏连程度[31],抑制皮瓣血栓形成,降低血管危象[32],降低肝移植术后胆道损伤[33]等药理作用。
2.3 人体药动学
注射用丹参多酚酸盐为淡黄色疏松体,易溶于水、醇,难溶于丙酮。丹参乙酸镁为主要成分(80%-90%),紫草酸盐、迷迭香酸盐为次要成分(10% -20%),其他的多酚酸盐成分均为小于1%的微量成分。因此,以丹参乙酸镁的含量作为丹参多酚酸盐及其粉针剂的质控标准,从面保障了产品质量均一性和疗效的稳定[8]。
2.3.1 吸收
在对健康志愿者的人体研究中,静脉给药后1h内可达到峰值血药浓度,且男性和女性的药动学参数无统计学差异。
2.3.2 分布
丹参多酚酸盐的表观分布容积(Vd)大,静脉给药后迅速分布至全身。连续给药后,清除率明显增大,曲线下面积显著减小,药物在体内没有蓄积。在对SD大鼠研究中,发现3个主要成分在心、肝、脾、肺、肾、脑组织中广泛分布。
2.3.3 消除
丹酚酸B(LSB)经由肝脏的儿茶酚-O-甲基转移酶(COMT)和酯酶代谢。而其主要以胆汁排泄方式从体内消除[38]。
丹参酚酸盐在体内主要经胆汁排泄,不同给药剂量下其主要成分LSB的低尿排泄量也提示肾脏分泌不是主要的排泄途径。
2.4 药动学-药效动力学(PK-PD)
健康志愿者研究中分别静脉滴注丹参酚酸盐200、300、400mg,用药后不同时间进行血药浓度分析发现:每天1次静脉滴注24h中大部分时间维持在很低的药物浓度,用药7h以后,体内药物存留不到1%。从药动学参数来看,丹参酚酸盐在健康人体分布广,消除快,对血小板聚集率和黏附率均有降低作用,前者达峰时间在滴注给药末,后者在停滴后3h,均呈现滞后效应,而对血小板聚集率较黏附率达峰快。
2.5 药物相互作用
丹参多酚酸盐在临床上与很多药物联用均可发挥协同作用,提高疗效。如当患者合并糖尿病或需控制血糖时,临床有将注射用丹参多酚酸盐与胰岛素混合调配于5%葡萄糖注射液中,以抵消溶媒中所含糖对患者血糖的影响[39-40]。而丹参及其复方制剂与包括溶媒[41-42]、抗菌药物[43-51]、维生素类药物[52-53]、心脑血管药物[54-56]、中药注射剂[57]、消化系统药物[58-61]、麻醉镇痛药[62-63]、精神类药物[64]及其他一些药物在内的药物配伍或联用时,易引发不良反应,在临床使用中需引起注意。
3 注射用丹参多酚酸盐的质量评价
3.1 药品的质量控制
3.1.1 质量标准
注射用丹参多酚酸盐以丹参乙酸镁作为质量控制标准;利用现代中药提取精制工艺,充分富集有效成分,成功研制出丹参多酚酸盐及其注射用丹参多酚酸盐,新的质量标准能充分反映该药的临床疗效,并与原有的丹参制剂(以丹参素或原儿茶醛为指标成分,以药材用量控制质量)存在本质上的不同。以指纹图谱技术全面控制药材、原料及制剂的质量;以冻干粉针技术确保产品有效成分的稳定性。
注射用丹参多酚酸盐现行标准为《国家食品药品监督管理总局国家药品标准》,标准号:YBZ07562005-2010Z-2013,于2014年6月25日开始实施。该标准分别从性状,鉴别,检查,主要包括可见异物、不溶性微粒、pH值(4.0~6.0)、水分(≤5.0%)、炽灼残渣(4.0%~7.0%)、重金属及有害元素、热源、溶血与凝聚、异常毒性、降压物质、过敏反应物质、无菌、含量测定、镁离子含量(>2.5%)等方面进行规定。
在安全性控制方面,对热原,溶血与凝聚,异常毒性,降压物质,过敏反应物,重金属及有害物质等进行检查,与法定标准一致,保证产品的安全性。
在质控成分丹参乙酸镁的质量控制方面,通过高效色谱法进行含量测定,本品每瓶含丹参乙酸镁量应为标示量的90%~110%。
在微量成分的质量控制方面,通过指纹图谱进行控制,以丹酚酸B为S峰,供试品指纹图谱(扣除 S峰)与对照指纹图谱(扣除S峰)比较,相似度不得低于0.90。
在对产品中的镁盐特征质量控制方面,通过离子色谱法对镁离子的含量进行测定,镁离子含量>2.5%。
通过该标准,既保证了丹参多酚酸盐的安全性,又对有效成分和微量成分进行控制,镁盐的特征也得到了确认,从而使产品质量可控。
3.1.2 生产厂家的实施情况
注射用丹参多酚酸盐的厂家(上海绿谷制药有限公司)质量标准在水分(≤5.0%)、不溶性微粒(含10μm以上微粒≤6000粒·瓶-1;含25μm以上微粒≤600粒·瓶-1)、装量差异方面要求稍高于国家标准,其他方面均与法定标准相同。
3.2 上市药品的质量再评价
药品检验机构在2017~2019年期间对注射用丹参多酚酸盐产品进行多次飞行抽检,检验结果显示产品质量符合各项标准规定,质量均一。根据厂家提供的2017~2019年注射用丹参多酚酸盐成品的质量分析报告,均符合法定要求,其中有效成分丹参乙酸镁的含量符合标准(标示量的90.0%~110.0%);相关的上市后质量评价文献较少,且大多以建立新的质量检测方法为主,从中提取相关的数据进行质量评价。质量再评价分别从产品的均一性和稳定性两方面进行评价。
3.2.1 均一性
2017~2019年不同批次的注射用多酚酸盐各项检查项目均符合质量标准,无异常。以下为主要成分丹参乙酸镁的含量趋势分析。
2017年注射用丹参多酚酸盐产品共624批。丹参乙酸镁含量全年标示量最高值为102.62%,最低值为99.60%,平均值为102.57%,均在合格范围(107%≥成品标示量内控≥93%)之内,全年数据整体良好,趋势波动正常。
2018年全年注射用丹参多酚酸盐成品共428个批次,均在合格范围内,其中丹参乙酸镁含量标示量的最高值为106.9%,最低值为99.0%,平均值为103.25%,±3σ值分别为106.87%和99.63%,全年数据整体良好,趋势波动正常。
2019年全年注射用丹参多酚酸盐成品共388个批次,均在合格范围内,其中丹参乙酸镁含量标示量的最高值为106.6%,最低值为100.0%,平均值为103.24%,±3σ值分别为106.78%和99.69%,全年数据整体良好,趋势波动正常。
3.2.2 稳定性
文献[65]中注射用丹参多酚酸盐的短期稳定性评价,多以其不同溶媒和(或)不同温度下,配伍液的含量、外观、pH值及不溶性微粒的数量变化进行评价。研究数据表明,在室温下,注射用丹参多酚酸盐与0.9%氯化钠溶液和5%葡萄糖溶液溶剂配伍后6h内含量,pH值稳定,测得微粒均符合药典规定,可安全使用。
3.3 质量指标统计分析结果
根据厂家提供的2017-2019年注射用丹参多酚酸盐质量指标统计分析,2017~2019年不同规格、不同批次成品的性状、鉴别、可见异物、不溶性微粒、重金属及有害元素、无菌、热原、溶血与凝聚、异常毒性、降压物质、过敏反应物质、指纹图谱、鞣质、蛋白质、树脂、钾离子、草酸盐、微生物限度、丹参乙酸镁含量等检测项目均符合质量标准。对2017~2019年全年成品的pH值、水分、炽灼残渣、丹参乙酸镁含量(标示量)进行绘图分析,全年成品(50、100、200 mg·瓶-1)质量稳定,所有数据均在合格范围内,且无不良趋势。上述结果显示,现行的成品质量标准适用,无需变更。
4 评价结果与建议
4.1 药学研究内容丰富,探索范围广
丹参多酚酸盐在有效成分、作用机制、药理效应、药代、药效、相互作用及剂型特征等各个方面的研究文献丰富,没有明显的基础研究证据缺失。在作用机制与药理效应方面,丹参多酚酸盐的研究探索面非常广,药物的超说明书用法都有相应机制路径与药理学研究基础,也为今后开展相关研究提供了思路和依据。
4.2 质量检验结果良好,均一稳定可控
注射用丹参多酚酸盐进行了含量、无菌、稳定性、内毒素等方面的质量再评价,并有相对优质的文献发表,其以丹参乙酸镁为质量标准,质量稳定、含量均一。
较好的质量控制和质量研究可能与该药较好的安全性表现相关。
4.3 成分特征研究值得继续深入
在有效成分和药物作用机制方面,丹参多酚酸盐已经进行了大量的基础研究。但作为丹参的水溶性提取物及其作用机制特别是作用靶点还有待进一步探索。如申报新适应证,可能需要补充相关基础研究。
参考文献见原文(点击文末“阅读原文”下载原文件)
来源:中国药学杂志
作者:韩晟,赵熙子, 史录文,林丽开,李大魁,陈凯先,宣利江,马传江,马海英,方唯一,王丽霞,文爱东,付秀娟,左燕,刘小玲,刘向红,刘国强,朱珠,陈万生,陈维红,吴方建,吴玉波,吴晖,张伟,张毕奎,林慧,周国华,欧阳荣,胡元会,姜明燕,赵春景, 贾乐川,晋月萍,唐洪梅,曹俊岭,梁春,商洪才, 董占军,董吁钢,翟所迪
声明:登载此文章目的为更广泛的传递行业信息,不代表赞同其观点或对其真实性负责。文章版权归原作者及原出处所有,文章内容仅供参考。本网拥有对此声明的最终解释权,若无意侵犯版权,请联系小编删除。若有不同意见,也欢迎留言反馈,谢谢。
由中国研究型医院学会、河南省医学会联合主办,健康界传媒独家媒体支持的“2014中国研究型医院高峰论坛”,2014年6月6日上午在河南郑州隆重召开。会上,中国人民解放军总后勤部副部长秦银河作了《创建研究型医院的战略思考》的主题报告。该报告站在时代和全局的高度,从创建研究型医院的战略意义、战略构想和战略指导三个角度,详细阐述了研究型医院建设的战略规划和科学举措,具有重要的指导意义。

各位领导、同志们:
受学会委托,我以创建研究型医院的战略思考为主题,作一个发言,从三方面与医院同仁共同探讨:
一、创建研究型医院的战略意义
毛泽东同志指出:“判定认识和理论之是否真理,不是以主观上觉得如何而定,而是依据客观上社会实践的结果而定,真理的标准只能是社会的实践。”
十年来,军地医院实践已经充分证明,研究型医院渊源于党的创新理论科学指导,植根于我国医院管理厚实基础,催生于新科技革命创新浪潮,借鉴于西方发达国家经验做法,回答了新的历史条件下医院发展时代命题,是历史必然性和时代进步性有机统一的医院管理理论,具有重大而深远的指导意义。
(一)推动我国医疗卫生事业全面进步的战略抓手,具有重要的政治意义。在全面建成小康社会的历史进程中,如何确保13亿人民群众健康水平持续提升,是我们党执政的重大历史使命。医院是医疗卫生事业的主体,创建研究型医院,目的就是要把医院锻造成为医疗卫生战略的科技创新基地,通过深化拓展医院的功能定位、职责使命、目标任务、措施要求,使我国卫生事业步入世纪发展前列,为实现中国梦、健康梦提供有力支撑。
1.研究型医院要求树立“大健康理念”。将医院的功能由疾病治疗向终生健康维护拓展,强化及时科学的个性化健康预测、预防和干预,从而构建起以研究型医院为核心,辐射各类社区医院、防疫机构、社会福利机构、干休所、养老院等健康保障实体,形成信息一体、技能明确、分工配合、有机互动的普惠式健康维护体系,以优质高效、安全廉价的方式满足人民群众健康需求,使大多数人终生保持健康状态,努力实现2020年全国期望寿命达到75岁,出生缺陷发生率由目前的5.6%控制到1%以下的目标。
2.研究型医院要求树立“大安全理念”。将医院的定位由维护人的生命和健康安全向维护公共卫生安全、国家生物安全拓展,依托医疗资源和科技资源密集的双重优势,持续增强自主创新能力,在政府机构的主导下,构建起以研究型医院为主体、科研院所为后盾、防疫机构为一线、各类生产厂家为支撑的国家生物安全和公共卫生体系,达到全城覆盖、攻防兼备、多元一体、及时高效,能够有效应对西方生物战略威慑、生物恐怖主义、新型传染病传播、外来生物入侵等重大安全威胁和严峻挑战。
3.研究型医院要求树立“大服务理念”。将医院的职责由区域性服务向全国乃至全世界拓展,通过深度应用数字化技术,打破传统医疗服务的时间和空间限制,使研究型医院的优势特色技术能够便捷地服务到每一个人,使各种疑难疾病能够得到汇集式诊断,使每一个人的健康信息在每一个医院能够实时监测共享,使研究型医院的各类数据信息开放式优化配置,以研究型医院为基础,在保护好患者隐私的前提下,构建起技术共享、服务均等、资源共用、终端全维的医疗服务保障体系,改变我国地域间、城乡间医疗资源配置不均衡的现状,从根本上缓解看病难、看病贵的问题。
(二)抢占世界医学科技革命制高点的战略抉择,具有重要的时代意义。当前,生命科学呈现多点突破、交叉汇聚的态势,正处于革命性突破的前夕。创建研究型医院,就是顺应这一时代潮流,紧紧抓住新科技革命强势变革的难得机遇,全力推进我国由经济大国成为科技强国的战略举措。其独特优势主要体现在三个方面:
1.转化医学研究体系的组织优势。创建研究型医院,要打破基础医学研究与药物研发、临床及公共卫生领域的屏障,搭建起相互贯通、跨学科领域的三级转化医学研究体系:一级是国家转化型研究网络,以国家为主导,在全国各地建立科研机构与医院紧密整合的转化研究机构。建立国家级转化型科学设施、生物数据库、人群和临床样本库、电子健康档案库等支撑系统,着重提升测序技术自主创新和基因组数据分析能力,推动基因组学向临床医学转化。二级是地区转化型研究中心,以地方政府为主导,以地区科技优势、地方疑难危重病或国家重点扶持的生物科技产业为纽带,以人才设备开放共享和关键技术创新为支撑,组建医院、院校科研单位、企业一体联合的转化研究中心,打造有特色优势的区域性转化医学研发产业链条。三级是医院转化研究平台,以研究型医院为主导,以疑难病、罕见病、重大疾病的诊治为牵引,多方组建临床医生与科研人员有机组合的科技创新团队,积极搭建临床与科研一体共用的学术平台。
2.立足生命科学前沿的技术优势。21世纪以来,人类在分子、基因、蛋白质等各组学的基础研究不断取得重大突破,尤其是人类基因组测序工作的完成,使得大部分癌症、心脏病、糖尿病、神经性疾病等上百种罕见疾病的致病机理已被破解。创建研究型医院,就是要通过系统生物学和转化医学的衔接、临床与科研的融合、微观到宏观的贯通,在前沿技术领域抢占干细胞、脑科学、合成生物学、超高分辨率活体成像、新型疫苗、分子机器等六个制高点,以纳米尺度的分辨率观察生物大分子在细胞内的定位,掌握生物分子、生物体部件、生物反应系统、代谢途径与过程,获得从分子水平上预测、预防和治疗疾病的能力,实现疾病诊断的划时代变革。
3.生物技术与其他学科交叉融合的模式优势。创建研究型医院的目的是通过创新寻求人类各种疾病致病机理和防治途径,但许多疾病特别是重大慢性病,是在众多生物分子、细胞、组织等共同影响和作用下形成的复杂性疾病,尤其随着DNA芯片技术和蛋白质谱技术的发展,给生命科学研究带来了海量实验数据,这就要求必须整合生命科学不同学科,以及计算机科学、信息科学和数学等新兴交叉学科来开展研究,依靠生命系统建模、大数据等先进技术和科研范式,实现各领域海量数据的获取、存储、管理、深度化分析和可视化展示,才能发现基因和蛋白质层次的新知识新规律,为疾病诊治找到最佳技术技能。
(三)有效维护当代人类身心健康的战略支撑,具有重要的社会意义。创建研究型医院的直接动因,是紧跟人类疾病谱变化,针对各种疾病威胁和挑战,适时提出顺应时代发展要求的健康维护与促进的方法手段。
1.把应对五大疾病威胁作为主攻方向。
(1)临床疑难危重病。包括多器官功能衰竭、自身免疫性疾病、非可控炎症恶性转化等,在临床实践中难以有效应对、无法根本解决。(2)重大慢性病。包括癌症、代谢性疾病、神经性疾病、心血管疾病等,并发症多且危害大,很难予以彻底根治。数据显示,我国确诊的慢性病患者已逾2.6亿,慢性病的死亡率占总死亡率的85%,糖尿病患者已达1.14亿,占全球糖尿病总患者的1/3。仅患重症精神病患者就有1600万,其中70%得不到完整的治疗,患有抑郁症的3000多万。(3)多发新发传染病。艾滋病、病毒性肝炎、耐药性结核病,以及其它抗药性病原的扩展和流行,仍然严重危害着人类健康;新型强致病性流感和其它烈性传染病亦在散发和流行,抗药性“超级细菌”在全球范围内正威胁着人类生命。(4)老年性疾病。我国60岁以上人口有2.02亿,80岁以上高龄老年人口达2300万人,失能、半失能老人达3700多万人,老年痴呆、老年心血管病、老年肺心病等成为社会和家庭沉重的经济和精神负担。(5)出生缺陷类疾病。我国目前有5000万至6000万的先天性缺陷和残疾人。此外,因创伤、疾病、遗传及衰老等造成的组织器官缺损或功能障碍的人数,也位居世界之首。
2.把催生八类创新成果作为主体任务。在生物医学和临床基础研究上,设计更有效的基因和生物治疗手段,研发有效的新型疫苗,克服机体的免疫系统所产生的负性调节作用,探索提出疾病的个体化治疗、系列化健康指导、心理缺陷干预、慢性病防治等新思路新方法;在临床诊治的实践中,利用合成生物学技术和工程平台,及时总结,善于发现,并大力开展针对退行性疾病和代谢性病变的干细胞治疗,微创技术、器械与药物组合技术、基因组学技术等新业务新技术;在临床医学研究中,着眼于更多更好地服务患者,重点加强靶点的确认和优化,以及高清晰药物靶标结构信息的获取,发展基于靶标结构的药物开发技术,开展高空间和时间分辨率、高穿透性等方向的生物成像技术研究,研发更加安全、方便、快捷、有效的疾病治疗新药物新设备;将发病机制与诊断、预防及治疗环节紧密结合起来,把防治疾病和促进健康有机融合,推动医学模式由疾病治疗为主向预防、预测和干预为主转变,由单一的生物医学模式向生物-环境-心理-社会的汇聚式医学模式转变,构建起基于现代生命科学技术发展的医疗服务新模式新体系。
3.把丰富人类健康知识宝库作为主要贡献。通过临床和科研的交叉融合、相辅相成、循环往复、螺旋递升,不仅能够显著提升临床疗效,而且对于基础研究产生强大的助推作用,有效深化人们对医学科技发展态势、疾病诊治医疗和健康维护规律的探索认识。比如,在慢性病防治中,逐步揭示各类慢性病相关的遗传因素和环境因素、营养因素及其相互作用,从组织到个体的不同层次上阐明疾病的表现形态;在传统病防治中,逐步揭示重要病原体的跨种传播机理、感染致病机制、病毒和宿主的相互作用关系,掌握不同个体对病原体感染的易感性、免疫应答、免疫耐受、免疫逃逸的差异机制等;在神经性疾病防治中,逐步揭示人脑功能连接图谱及遗传基础、结构和异常机制等。对这些成果加以凝练提升,形成学术观点,通过不同途径(文章、著作、讲座等)被其他医疗同仁学习、完善,成为普遍接受的学术思想,在更大的范围内回到临床并指导实践应用。这些经过长期临床实践检验的新思想,并持续催生医学新学科新专业,不断丰富和发展医学科学的知识宝库。
(四)实现医院质量建设内涵发展的战略指导,具有重大的理论意义。恩格斯指出:“一个民族要想站在科学的最高峰,就一刻也不能没有理论思维。”创建研究型医院,就是对我国医院,尤其是改革开放以来建设发展历程的系统总结和理论升华。30多年来,为了解决人民日益增长的医疗需求与供给不足的矛盾,我国医院面向市场求发展,在投入不足、医疗收费低廉的情况下,医院建设不得不走了一条规模扩张道路,极大增强了医院综合实力,但随着医院达到一定规模,物质经费投入产生的效益越来越低,甚至不同程度地出现了忽视质量安全、盲目对外合作、医疗作风粗疏、淡化人文关怀、医德医风不端等不良现象。这些都说明,靠规模扩张推动医院粗犷性发展的老路已难以为继,必须以创建研究型医院为牵引,走出一条质量建设、内涵发展的新路子。在发展力量上,强调培养研究型人才,突出临床与科研兼优,既为医务人员个人发展提供了空间,也为医院内涵发展提供了内生动力;在发展基础上,强调创建研究型科室,以出高素质人才、高水平成果和高质量服务为发展特征,既为学科向高、精、尖、名、优、特发展提供了方向路径,也为医院质量建设奠定了坚实基础;在发展路径上,强调构建转化医学模式,把科技创新新成果转化为最优化的治疗方案和临床路径,形成独特的技术优势和鲜明的服务品牌,聚焦主要医疗资源用于诊治疑难危重病人和开展创新性技术,确保医疗技术的持续进步和医疗质量的稳步提升;在发展保障上,强调建设研究型医疗、研究型政工、研究型后勤和研究型护理,注重以患者为中心,不断创新管理保障的理论理念、模式机制、方法手段,实施以数字化技术为支撑的人性化、人文化、个性化、规范化管理,提高全过程优质服务,始终与患者同心同在,有力促进医院整体服务质量的提升。实践证明,只要坚持创建研究型医院,医院发展的质量就比较够高、效益就比较好,速度也比较快。
二、创建研究型医院的战略构想
研究型医院创建的基础是研究型学科,关键是研究型人才,核心是转化医学,支撑是数字化管理。这四个方面相辅相成、有机统一,共同构成“四位一体”的战略格局,从创建研究型医院的阶段性特征来看,当前,要重点推进四个模式的转型转变。
(一)临床诊疗模式由经验医学型向转化医学型转变
回顾创建研究型医院的实践,构建转化医学诊疗模式既是研究型医院的目标指向,也是战略突破口和现实切入点。总体上看,主要有六种基本路径:
1.升华实践经验。指的是在长期大量丰富的临床实践中,针对常见病、多发病的诊疗回顾,及时总结经验、梳理问题、分析成因、探寻对策、实现技术和手段的创新突破,是转化医学模式最普遍、最基本的途径方法,无论大小医院或科室,都具有引领性和可操作性。比如,二炮535医院眼科邓江稳主任探索一种L钩和一把常用T钩相互配合的手术方法,有效解决了晶状体硬核大核白内障患者的手术治疗问题,手术成功率达100%。撰写的论文在《美国白内障与屈光外科学杂志》发表,国际同行称赞这是一种不可思议的技术。
2.临床科学研究。指的是善于从临床实践中凝练重大临床科研课题,在前人研究结果的基础上,组织团队开展科技创新,取得疾病诊治的重大认知突破、技术突破或器具突破,这是转化医学模式最典型路径。比如,黎介寿院士历时40余年,系统开展肠外瘘、短肠综合征、小肠移植、营养支持、肠粘膜屏障的损伤与修复等研究项目,形成了肠疾病全系列治疗的标准和规范。
3.基础成果转化。指的是把基础研究的创新成果,通过各种途径转化为临床技术技能和方法手段,大幅提升临床诊治的效率效益,这是转化医学模式中层级高、力度大的创新途径。比如,吴孟超院士“五叶四段”的肝脏解剖新理论,黄志强原始“肝前叶切除”新术式,卢世璧院士神经因子再生新学说,盛志勇院士皮肤再造新技术,王士雯院士肺效动力学说等系列成果,开创了各专业领域的先河。此外,一些基因修补、基因敲除等先进生物疗法,以及系列生物新药研发,均是建立在对人类基因组基本规律深刻认识的基础之上。
4.产学医研联合。指的是医院、科研院所、学校企业的资源共享、优势互补、联合攻关,带着临床问题研发新药物、新技术、新器械,提高解决临床问题的能力,这是一种高效益的转化医学模式。比如,南京总医院与中国科学院联合研发了单人操作、负压可控、进针角度和深度更为准确的肾活检装置,提升了基层医院肾脏疾病诊断水平。
5.引进吸收创新。指的是通过引进、熟练运用先进一流的仪器设备和新业务技术,带动临床治疗水平整体升级,这是转化医学模式中短平快的有效方式。比如,2006年,301医院率先引进了四手臂“达芬奇”S机器人手术系统,治疗病种达24种,7中术式为国际首创,获得国家科技进步一等奖。
6.多科整合集成。指的是以某种疑难危重病诊治为牵引,打破学科专业界限,优化整合学科资源,聚力合作、集智公关,实现疾病诊疗水平的跃升。这是转化医学模式中操作性较强、综合效益较高的一种新途径。比如,西京医院联合神经内外科、心血管内外科等6个学科组成心脑血管疾病诊治优势学科群,创建了心脑保护防治新策略,荣获国家科技进步一等奖,自主研发的新药品获得1亿元转让经费。
(二)学科建设模式由临床型科室向研究型科室转变
建设研究型科室必须首先破除学科建设上自我发展、封闭运行、单一功能等陈旧观念,通过创新引领、科学布局、打通关联、重点扶持,构建形成特色鲜明、优势突出、相互支撑、功能多元的优质学科群,为创建研究型医院夯实坚实基础。
1.注重聚焦能力,优化集成建强综合学科,激发协同创新效应。以疑难病诊治、高新技术应用为纽带,组建跨学科诊疗中心、联合专病中心、综合治疗中心,组织好专业学科与亚专科、基础学科与临床学科、辅助学科的相互渗透、跨界融合,通盘筹划设计、统筹调配资源,构建平台、信息、技术、人才共享公用的学科建设模式,最大限度地提高医疗服务和科技创新能力。
2.注重专精发展,开放协作建成优势学科,汇聚集成创新效应。以重点学科为龙头,以疾病诊治为链条,以重大课题攻关为牵引,全方位组建临床医生与科研人员有机结合的攻关团队,积极搭建临床与科研一体共用的学术平台,创新完善以转化效益为核心指标的评价体系,细化强化亚专科建设,做精、做强、做好专病专科,形成以大科研、大团队、大协作为标志的优势学科群,推出更多具有原创性的高等级成果和创新技术,使优势学科更加强势,专业特色更加鲜明。
3.注重超前布局,紧跟前沿建立新兴学科,营造后发创新效应。把握生命科学和医学科技的发展趋势,尤其是要瞄准基因组学、蛋白质组学、代谢组学、系统生物学等国际新型学科,建成实验室与临床有机衔接的完整技术链,加强新兴学科对传统学科的辐射、孵化与衍生,充分利用后发优势交叉融合优势和综合集成优势,建立一批国内外有一定学术影响力的高端引领学科。
4.注重因地制宜,立足地域建好品牌学科,凸显特色创新效应。中小医院要以地方病、常见病诊疗的新技术新方法为抓手,围绕地域性流行病、常见病多发病,强化病种积累,加强概括总结,注重升华提炼,形成具有创新价值的临床应用性课题研究。持续深化创新,着力破解地方病、常见病诊治难题,不断推出疗效显著、安全可靠的“一招鲜”式的新技术新方法新器材。
(三)人才培养模式由素质单一型向复合研究型转变
研究型人才是研究型医院最具活力的因素,也是最可靠的支撑力量。当前,要突出抓好研究型人才的分级分类培养。在临床与科研兼优、以创新为核心素质的前提下,研究型人才可以划分为七类:
1.研究型领军人才。主要是指医学大家大师,能开创学术领域,提出原始创新、自成体系、同行公认的学术思想理论和观点,在某一领域或疾病的诊治中,创造性提出独具特色、疗效显著、同行认可并可推广应用的诊疗方法和药品器材、培养造就一大批,甚至几代卓越人才,学术严谨、造诣深厚、品德高尚、受人景仰,医学成就和学术地位在国际上有较大影响。
2.研究型临床人才。主要是指名医名家,这类人才具有丰富的临床实战经验和精湛的临床技能,能够敏锐发现临床需求中的问题和困惑,善于凝练提出、创新突破临床应中的重大疑难问题和常见病多发病诊治技能,研究成果能有效促进专科或专病诊疗水平的跃升,并能普遍应用和得以推广,在国内外有一定影响。
3.研究型科研人才。主要是指科研创新能力较强,在基础研究领域取得高等级成果,特别是在疾病诊治机理上有新发现新进步新突破,学术思想有前瞻创新、学术观点有独到见解。研究成果转化应用有显著临床疗效,能产生良好的综合效益。
4.研究型教学人才。主要是指名师,主编或撰写过有深远影响的经典教材、专著或论文,善于在临床教学实践中总结、概括、传授医学创新成果和临床诊治经验,培养出出类拔萃甚至超越自我的优秀人才。
5.研究型技术人才。主要是指善于创造性利用先进设备和药学技能的医学辅诊人才,能够研发仪器设备和药品应用的潜在功能用途,提出设备和药品改进提升的可行设想,更加高效精准的辅助临床医疗,甚至能够提出依靠设备组合和用药监测直接提高医疗质量和水平的创新效果。
6.研究型护理人才。主要是指能够在临床护理中,创造性提出科学的护理理念、护理理论、护理规范和护理技术标准,甚至能够提出药品配伍、诊疗方法、一起设备等改进的有效方法和创新技能。
7.研究型管理人才。主要是指各级医院管理人员,善于科学研究制定医院战略规划和实施路径,创新管理理念、理念、思路和机制,能够总结制定新标准新规范新制度新机制,并在实践中取得上下公认的显著管理效益,在行业领域得以推广应用。
这七类人才在研究型医院中的地位作用不同,都是创建研究型医院的宝贵资源,必须加倍珍惜。各医院应该根据功能定位和实际需求,有重点有计划地培养和引进各类人才,使结构科学合理、梯队趋为优化;提高研究型人才培养使用的综合效益。
(四)组织管理模式由层级架构型向网络数字型转变
医院是研究型医院的现代化组织形态。以宽带化、智能化为特征的新一代互联网与医疗行业的融合,为研究型医院建设带来了新的发展机遇,没有基于数字化的一体化,就不可能有高水平高效益高质量的研究型医院。数字化管理发展目标要确立四个发展阶段:
1.第一阶段,基础设施升级。紧跟物联网技术的发展,依靠高速的通信网和互联网,构建起与人工管理体系平行的网络管理系统,能够实现各类管理数据的海量获取、复杂模拟、及时反馈和自动调控,做到“人-机-物”的三元融合,有力支持医院科学决策、高效管理和精确保障。
2.第二阶段,实时精准监控。在第一阶段基础上,进一步实现对医院管理常态化和非常态化数据的实时获取、精准监控、全程覆盖和动态分析,对诊疗服务过程、药材配给以及后勤运行流程、经费全程管理,乃至患者人流、车流及水电气暖等地下管网的智能化控制。
3.第三阶段,辅助管理支持。构建医院管理综合信息系统、智能分析和决策系统,在运行监控的基础上,完善医院各类事物的常态和应急管理机制。在医院人流、物流、资金流智能控制的基础上,实现对医院公共设施和环境的智能管理控制,由单系统分别控制扩展到全程透明、综合集成控制。
4.第四阶段,决策研判智能化。进一步整合医院的系统级应用,建成数字机关、数字科室、数字病房、数字实验室、数字库房等,实现医院管理各级职能的数字化,尤其是通过大数据技术分析、预测、研判医院发展的现状、短板、趋势和走向,能够研发指导医院建设管理的长期性、方向性备选方案,使医院的各项决策都建立在信息化、数据化、智能化、智慧化的基础上。
三、创建研究型医院的战略指导
创建研究型医院,是一项复杂的系统工程,必须站在时代和全局的高度,对医院的功能定位、形势任务、发展方向、顶层设计等重大问题进行理性思考,把革命性、跨越性和渐进性、阶段性统一起来,形成正确的战略判断和战略决策,推出科学的战略规划和战略举措。重点是统筹好“六个把握、六个坚持”。
(一)把握研究型医院的规律性,坚持领导先行、科学推进。创建研究型医院的前提和关键是要有研究型领导,就是要牢固树立正确的政绩观,能用宏观战略眼光分析问题、把握大势、管控全局,做出前瞻性、创新性、创造性的重大决策。研究型领导至少应该具备以下四个方面的素质:
1.政治思想水平。一看是不是忠诚,理想信念是否坚定;二看想不想奉献,能否为党的事业舍弃个人利益;三看敢不敢作为,大事难事面前是否敢承担责任;四看收不收规矩,廉洁自律是否严格;五看有没有胸怀,能否搞好班子团结。
2.完备知识结构。医院无论大小都是一个跨行业、跨领域的复杂系统,研究型医院的各级领导,特别是院长,不论是医生出身、还是其他岗位转行,都不仅要熟练掌握业务知识,而且也要懂政治、经济、法律、教育、科技,甚至金融、人文、哲学等各门类的知识。军队医院的院长还要懂军事和懂卫勤,才能为科学筹划研究型医院建设奠定良好的思想文化底蕴。
3.战略思维素养。主要是五种思维:一是全局思维。就是立足世界科技发展大背景,社会经济发展大战略、医疗卫生事业大格局,始终能认清和把握医院发展的科学定位。二是辩证思维。既要看相对竞争优势,又要看软件,找准医院创新发展的阶段性特征。三是前瞻思维。就是从医学科技发展前沿、医院建设发展大势和疾病诊治原则规律的高度,科学预见和研判研究型医院的发展方向和思路举措。四是,系统思维。就是既要优化组合,充分激发资源和结构的功能潜力,又要注重功能牵引,科学设置、持续创新结构体系,实现整体发展、协调进步。五是底线思维。就是从最坏处着眼、向最好处努力,牢固树立综合安全观,增强战略应变能力,建立健全系统综合安全的管理体系、应急预案和考评标准,确保政治安全、医疗安全、经济安全、信息安全和行政安全。
4.组织协调能力。研究型领导的理念、胸怀、睿智、气度至关重要,不仅要有大气非凡的领导力、前瞻果敢的决策力,一以贯之的执行力,与时俱进的创新力,还要有高超的表达力、亲和能力、交往能力、斡旋能力和协调沟通能力,能够有效传播医院的发展理念、战略规划、价值追求、医院文化,树立良好形象,凝聚人心力量,调动院内的积极性、主动性创造性,赢得员工和患者信任,主动获得政策、资金、技术和人才上的资助支持。
(二)把握研究型医院的人文性,坚持以人为本、患者至上。持续提高疾病的预防、治疗和康复能力,是创建研究型医院的出发点和落脚点。要坚决防止和克服重研究轻看病甚至只研究不看病、重论文发表轻临床能力、重课题报奖轻成果转化等错误倾向,着力创新构建以患者健康需求为核心的医院运行服务体系、以提高疑难危重病救治水平为基点的医疗诊治体系、以推动医学创新成果及时转化应用为目标的临床科研体系,以鼓励成果转化应用为导向的指标评价体系,坚定研究型医院的正确方向,确保患者及时享受到安全精准、高效经济的个性化人性化医疗服务。
(三)把握研究型医院的先进性,坚持创新驱动、人才第一。创建研究型医院的主旨要义,是向质量建设、内涵发展转型。要坚持把技术创新、机制创新、管理创新作为基本动力,防止单纯追求资源投入扩大规模;要坚持把培养高层次人才作为基本支柱,防止一味不计成本,更新设施设备、升级换代;要坚持以综合效益为基本目标,防止单纯增加医疗毛收入的错误倾向;要坚持以提升医疗质量为基本途径,防止盲目追求门诊量、住院量、手术量等数量指标;要坚持以科学精细管理为基本抓手,防止大手大脚的粗放概略式运行,实现质量效益型发展,增强医院的核心竞争力。
(四)把握研究型医院的普适性,坚持因地制宜、因院制宜。创建研究型医院虽然要高标准高质量,但绝不是高不可攀的、可望不可及的空中楼阁。要坚决防止和克服大医院能创建、中小医院难创建,综合性医院能创建、专科医院难创建,发达地区医院能创建、欠发达地区医院难创建的片面认识。要深刻认识医院建设的阶段性特征和发展战略,科学统筹竞争优势和短板弱项,准确把握发展机遇和风险挑战,既要看基础设施硬件,又要看管理人才等软件,既要看技术,又要看人文,立足客观实际,善于开动脑筋,既要重点突破带动整体发展,又扬长避短,有所为有所不为,把局部先行与整体推进有机结合起来,确保研究型医院进度、质量与效益有机统一。
(五)把握研究型医院的开放性,坚持内外协调、共同发展。研究型医院是一个兼容并蓄、合作共赢、高度开放、融合交流的和谐系统,要防止和克服自我封闭、条块分割、唯我独尊、自成体系的错误倾向。坚持以我为主,协调各项,优势互补,合作共赢的发展理念,对内注重优化整合、盘活利用各方面资源,发挥全院“一盘棋”的整体优势;对外强调把创建研究型医院纳入国家创新发展全局来定位,融入军地医疗服务和科技创新体系来规划,与政府、企业和院校,最大限度地实现政策沟通、人才流通、信息通畅、资源融通、成果互通,做到与国防和军队现代化建设相协调、与国家医药卫生体制改革相同步。
(六)把握研究型医院的传承性,坚持思想引领、文化兴院。研究型医院的血脉是先进文化,一流的医院文化是创建研究型医院的软实力,要坚决防止和克服只重视硬件不重视软件,只重视物质投入不重视文化建设的错误倾向,把文化作为灵魂工程来锻造、历史工程来传承、系统工程来建设。要靠规划、总体布局,切实摆上战略位置;要靠特色保持生命力,概括总结反映医院精神风貌和发展历史的医院思想、医院精神、医院作风和医院传统;要靠品牌增强影响力,不断推出能够引起全社会共鸣、受到广泛认可的医院先进人物、先进单位和先进事迹;要靠载体凝聚创造力,建好院报、橱窗、网络、院史馆、人物雕塑等宣教平台,创作好院风、院歌、院训、院徽等文化标志;要靠人文活动激发感染力,结合重大节日或医院纪念日,广泛开展喜闻乐见、健康向上、丰富多彩的主题活动,使研究型医院特色文化的导向、凝聚、激励和辐射功能熠熠生辉。